
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
一定温度下,将0.1molAgCl加入1L 0.1mol·L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是
A.沉淀转化反应2AgCl(s)+ CO32-(aq) Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1
Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1
B.约有2×10-5mol AgCl溶解
C.反应后溶液中的:c(Na+)>c (Cl-) >c (CO32-) >c (OH-) >c (H+)
D.反应后溶液中的:c(Na+)+ c (H+)+ c (Ag+)=2 c (CO32-)+ c (HCO3-)+ c (Cl-)+ c (OH-)
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
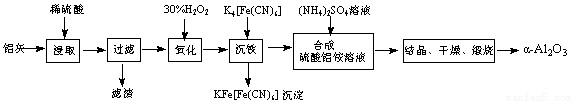
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 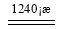 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
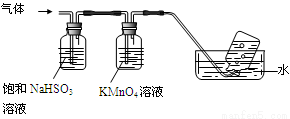
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
化合物A(分子式为:C6H6O2)是一种有机化工原料,在空气中易被氧化。由A 合成黄樟油(E)和香料F的合成路线如下(部分反应条件已略去):
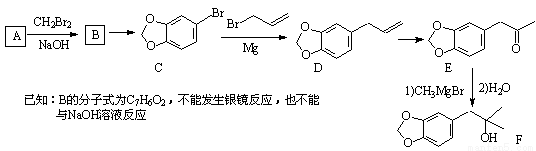
(1)写出E中含氧官能团的名称: 和 。
(2)写出反应C→D的反应类型: 。
(3)写出反应A→B的化学方程式: 。
(4)某芳香化合物是D的同分异构体,且分子中只有两种不同化学环境的氢。写出该芳香化合物的结构简式: (任写一种)。
(5)根据已有知识并结合流程中相关信息,写出以 、
、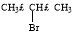 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br  CH2=CH2
CH2=CH2

查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:实验题
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN3的质量分数。实验步骤如下:
①称取约2.5000g叠氮化钠试样,配成250mL溶液。
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol·L-1
(NH4)2Ce(NO3)6(六硝酸铈铵),
[发生反应为:2(NH4)2Ce(NO3)6 +2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+= Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有 、 。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为 。
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按图图示读取,将导致所测定样品中叠氮化钠质量分数 (选填:“偏大”、“偏小”或“不变”)。
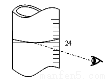
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)。
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是 。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是 。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 。
(4)实验时需强力搅拌45min,其目的是 ;结束后需调节溶液的pH 7~8,其目的是 。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水。
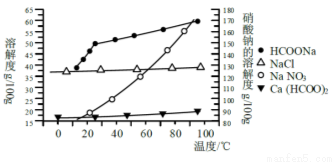
请补充完整由碳酸钙制备甲酸钙的实验步骤
金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
Fe3+ | 1. 1 | 3. 2 |
Al3+ | 3. 0 | 5. 0 |
Fe2+ | 5. 8 | 8. 8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2. 。
步骤3. 。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、 、洗涤、60℃时干燥得甲酸钙晶体。
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) △H3
则△H3 = kJ·mol-1。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4Cl·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为 。

(4)工业上用MgC2O4·2H2O热分解制超细MgO,其热分解曲线如图。
图中隔绝空气条件下B→C发生反应的化学方程式为 。
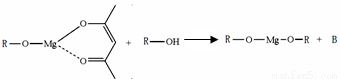
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为: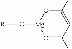 ,它可发生如下反应:
,它可发生如下反应:
ROH与B的核磁共振氢谱如下图:
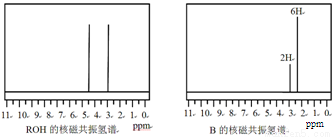
ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为 ; B的结构简式为 。
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
2013年诺贝尔化学奖授予三位美国科学家,以表彰他们在开发多尺度复杂化学系统模型方面所做的贡献。可以用量子化学计算小区间内(如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有由铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3以外,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有 (不定项选择)。
a.C2H2、C2H4都是非极性分子
b.碳负离子CH3-呈三角锥形
c.NO+电子式为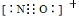

d.NH3沸点比N2高,主要是因为前者是极性分子
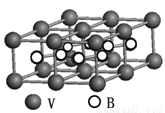
(2)钒可合成电池电极也可人工合成的二价钒(V)固氮酶(结构如下图)。
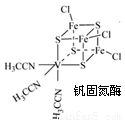
①V2+基态时核外电子排布式为 。
②钒固氮酶钒的配位原子有 (写元素符号)。
③熔融空气电池钒硼晶体晶胞结构如下图所示,该晶胞中含有钒原子数目为 。
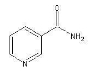
(3)烟酰胺(结构式如图)可用于合成光合辅酶NADPH ,烟酰胺分子中氮原子的杂化轨道类型有 ,1mol该分子中含σ键数目为 。
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:实验题
4,7-二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间甲苯酚为原料的合成反应如下:

实验装置图如下:

主要实验步骤:
步骤1.向三口烧瓶中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗品
步骤3.粗品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)图中仪品名称:a ,b 。
(2)浓H2SO4需要冷却至0℃以下的原因是 。
(3)反应需要搅拌12h,其原因是 。
(4)确定最终产品是4,7-二甲基香豆素的实验或方法是 。
(5)本次实验产率为 。
查看答案和解析>>
科目: 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
化学与材料、生活和环境密切相关。下列有关说法中错误的是
A.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C.大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D.新型材料聚酯纤维、光导纤维都属于有机高分子
查看答案和解析>>
科目: 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
①CSO的电子式:
②对硝基苯酚的结构简式:
③Cl-的结构示意图:
④甲烷分子的比例模型:
⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:
⑦ HCO3-的水解方程式为:HCO3-+H2O CO32-+H3O+
CO32-+H3O+
A.①④⑤B.②③④⑥ C.③⑤⑥⑦ D.全部正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com