
科目: 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
下列过程的离子方程式正确的是
A.用烧碱溶液吸收Cl2:Cl2+2OH- =Cl-+ClO-+H2O
B.用饱和Na2CO3溶液转化锅垢中的CaSO4:CaSO4(s)+CO32- (aq)=CaCO3(s)+SO42-(aq)
C.实验室制备Fe(OH)3胶体:Fe3+ +3OH- =Fe(OH)3↓
D.金属Na与水反应:Na +2H+ = H2↑+Na+
查看答案和解析>>
科目: 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
利用下列实验装置进行的相应实验,能达到实验目的的是
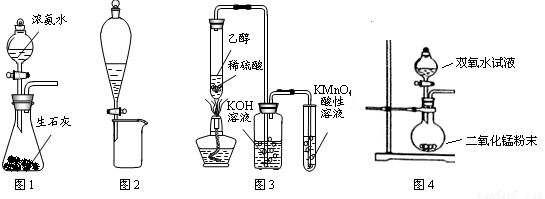
A.图1所示装置可制备氨气
B.图2所示装置可分离CH3CH2OH和CH3COOC2H5的混合液
C.图3所示装置可制备、收集乙烯并验证其易被氧化
D.图4所示装置可制备氧气
查看答案和解析>>
科目: 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:填空题
已知苯甲醛与乙酸酐[(CH3CO)2O]在一定条件下可以通过Perkin反应生成肉桂酸,方程式(已配平)如下:

苯甲醛 肉桂酸
(1)1mol苯甲醛与足量银氨溶液在水浴条件下反应最多能生成 mol银单质;写出肉桂酸完全加氢后产物的分子式 。
(2)上述反应中的产物M能与碳酸氢钠反应并放出气体,则M的结构简式是 。
(3)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,其反应方程式为
(不要求标出反应条件),该反应类型属于 。
已知:在药物、香料合成中常利用醛和醇反应生成缩醛来保护醛基,此类反应在酸催化下进行。例如:
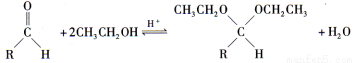
(4)已知具有五元环和六元环结构的缩醛比较稳定。写出用乙二醇(HOCH2CH2OH)保护苯甲醛中醛基生成的缩醛B(分子式:C9H10O2)的结构简式 。
(5)缩醛B(分子式:C9H10O2)符合以下条件的同分异构体有两种,写出它们的结构简式 。
①苯环上只有一个取代基;②能发生水解反应和银镜反应。
查看答案和解析>>
科目: 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:填空题
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:

①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1=-57.3 kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
查看答案和解析>>
科目: 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:填空题
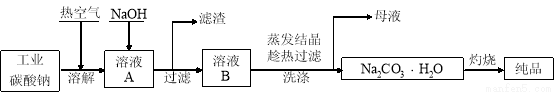
工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
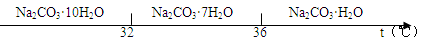
回答下列问题:
(1)溶解时通入热空气的作用有 (写出两条即可);生成氢氧化镁沉淀的离子方程式为 。
(2)“趁热过滤”时的温度应控制在 ;简述过滤后洗涤固体的操作 。
(3)为检验母液中是否含有Cl-,必须加入的试剂为 。
(4)实验室进行“灼烧”的陶瓷仪器有 。
(5)室温下用石墨电极电解饱和Na2CO3溶液(装置如图),写出Y电极反应式: ;一段时间后X电极可收集到的气体一定有 ,可能有 。
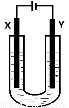
查看答案和解析>>
科目: 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:填空题
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:

请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式 ;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0g【已知有关摩尔质 量:M(Cu)=64g/mol, M(CuSO4·5H2O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是 ;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):
、 。
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
2013年10月世界卫生组织癌症专门机构首次指认大气污染“对人类致癌”。下列行为有利于防止大气污染、遏制雾霾天气发生的是
A.在田间焚烧秸杆
B.冬季燃烧大量烟煤供热取暖
C.提倡开私家车出行,减少乘坐公交车
D.改善能源结构,大力发展太阳能、风能等清洁能源
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.乙醇的结构简式 C2H6O
B.氨基的电子式 
C.镁离子的结构示意图 
D.中子数为79、质子数为55 的铯(Cs)原子 Cs
Cs
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞显红色的溶液:Na+、Mg2+、NO3-、HSO3-
B.0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-
C.0.1 mol·L-1氨水溶液:K+、Na+、NO3-、AlO2-
D.由水电离出的c(H+)=10-11mol·L-1的溶液:Ca2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目: 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A.氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B.碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污
C.氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却
D.铜的金属性比铁弱,可将海轮浸水部分镶上铜锭以减缓船体腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com