
科目: 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
前四周期元素X、Y、Z、W、Q的原子序数依次增大。X与Y同周期相邻,Y的基态原子s电子数与p电子数相等,Z是地壳中含量最多的金属元素,W的价电子排布为4S1,基态Q原子的未成对电子是同周期元素中最多的。下列说法错误的是
A. 简单气态氢化物的热稳定性:Y>X
B. 简单离子的半径:Z>X>Y
C. Z的最高价氧化物对应水化物既能与强酸反应又能与强碱反应生产盐和水
D. 由Y、W、Q三种元素形成的某种化合物,可用于检查司机酒后驾车
查看答案和解析>>
科目: 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列化学实验叙述正确的是
A. 实验室从海带中提取单质碘的步骤:取样→灼烧→溶解→过滤→萃取
B. 将饱和FeCl3溶液滴入沸水,继续加热煮沸至出现红褐色沉淀即得Fe(OH)3胶体
C. 要检验滴有稀硫酸的蔗糖溶液是否水解,可加入银氨溶液,再水浴加热
D. 钠的焰色反应实验需要用酒精灯、铂丝、氯化钠溶液和稀盐酸
查看答案和解析>>
科目: 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
常温下,将20mL0.1mol/L的HCl溶液逐滴加入到20mL0.1mol/LNa2C2O4溶液中。已知NaHC2O4溶液显酸性,关于反应混合溶液的下列判断不正确的是
A. c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4)
B. 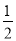 c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
C. c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4)
D. 加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小
查看答案和解析>>
科目: 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
已知反应2H2(g)+CO(g)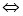 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |
K | 2.50 | 0.34 | 0.15 |
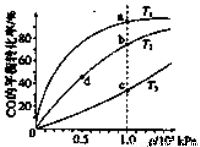
A. 平横常数:K(a)>K(c),K(b)=K(d)
B. 正反应速率:v(a)>v(c),v(b)=v(d)
C. 达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D. 平均相对分子质量:M(a)=M(c),M(b)>M(d)
查看答案和解析>>
科目: 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
20mL0.1mol/LFeCl3溶液中含有部分Fe2+,向其中滴加NaOH溶液至PH=4,溶液中有沉淀生成,过滤,得沉淀和滤液。已知:Ksp [Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16。
下列说法错误的是
A. 沉淀中只有Fe(OH)3 B. 沉淀中有Fe(OH)3和Fe(OH)2
C. 滤液c(Fe3+)=4.0×10-8mol/L D. 向滤液中滴加FeCl2溶液,无沉淀产生
查看答案和解析>>
科目: 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:简答题
(12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题:
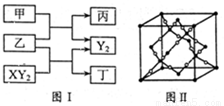
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中,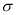 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
查看答案和解析>>
科目: 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:实验题
(16分)某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
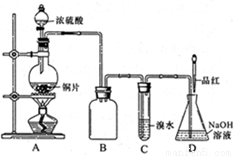
(1)装置A中发生反应的化学方程式
是_______,装置B的作用是_______。
设计装置C的目的是验证SO2的
_______________性,D中NaOH全部转化为
NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某
同学认为H2SO4也有剩余,他设计了下列实
验方案来测定剩余H2SO4的量。经冷却,定
量稀释后进行下列实验,能达到目的是________(填序号);
a. 用酸碱中和滴定法测定 b. 与足量Zn反应,测量生成H2的体积
c. 用PH计测溶液PH值 d. 与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 滴加少量淀粉碘化钾溶液,振荡 |
| III |
② | 滴加少量棕红色的KI3溶液,振荡 |
| II |
③ | 滴入加少量酸性KMNO4溶液,振荡 | 溶液呈紫色 |
|
④ | 加入几小块CaCO3固体 | 有气泡产生 |
|
查看答案和解析>>
科目: 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:推断题
(14分)含扑热息痛高分子药物F具有长效性、稳定性,毒副作用小,而且可以实现药物的缓控释。F的一种合成流程图如下图所示:
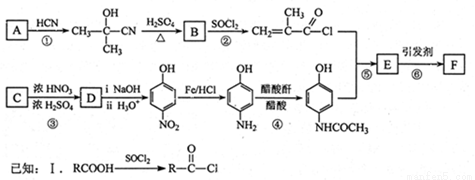
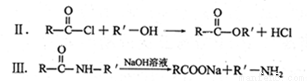
请回答下列问题:
(1)①是加成反应,则A的结构简式为_______,B中官能团的名称是________。
(2)C的名称是____________。反应②~⑥中,属于取代反应的是_________。
(3)反应⑤的化学方程式是__________________________。
(4)F与足量NaOH溶液发生反应的化学方程式是__________________________。
查看答案和解析>>
科目: 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:简答题
(16分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
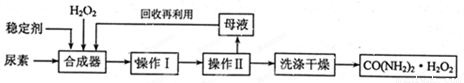
请回答下列问题:
(1)操作I、II的名称分别是______、_______。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3KJ/mol、285.8kJ/mol
②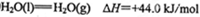
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:_______________。
(3)合成过氧化氢尿素加入的稳定剂可以是水杨酸、酒石酸等。酒石酸分子式为C4H6O6,其核磁共振氢谱只有3种锋,只含羧基和羟基两种官能团,则酒石酸的结构简式为_____。
(4)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMO4溶液与尿素不反应).
①完成并配平方程式: MnO4-+
MnO4-+  H2O2+
H2O2+  _________=Mn2++
_________=Mn2++ O2↑+
O2↑+ ___;
___;
②计算出产品中H2O2的质量分数为_______。
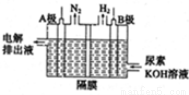
(5)电解尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,B两极均为惰性电极。B极连接电源的____极(填
“正”或“负”),阳极电极反应方程为_____________。
查看答案和解析>>
科目: 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
“绿色化学”要求化学反应尽可能不产生“副产物”,下列反应最符合“绿色化学”要求的是
A.苯乙烯在一定条件下制聚苯乙烯B.乙醇与浓硫酸共热制乙烯
C.乙醇催化氧化制乙醛 D.乙烷与氯气反应制氯乙烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com