
科目: 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)下图是一个化学过程的示意图。
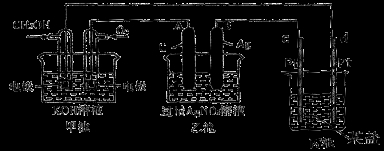
(1)图中乙池是 装置。
(2)c(Pt)电极的名称是 。
(3)写出通入CH3OH的电极的电极反应式是 。
(4)乙池中反应的离子方程式为 。
(5)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下);此时丙池某电极析出1.6g某金属,则丙中的某盐溶液可能是 (填序号)
A. MgSO4 B.CuSO4 C.NaCL D.AgNO3
查看答案和解析>>
科目: 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
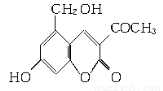
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。 写出其属于醇类的同分异构体的结构简式___________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与3 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式 。
查看答案和解析>>
科目: 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:填空题
(12分)铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁
与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物
为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析
下图,回答有关问题。
假设曲线的各段内只有一种还原产物。
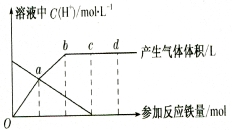
(1)0点到a点的还原产物是 ________ __ 。
(2)a点到b点的还原产物是__ __,其原因是 。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe( NO3)3+口[ ]+口H20。
(4)反应过程中,到达 ________ 点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是 。
(6)c点和d点参加反应的铁的物质的量之比是 ___________ 。
查看答案和解析>>
科目: 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
化学无处不在,下面说法正确的是
A.“地沟油”禁止食用,但可用于制造生物柴油
B.“PM2.5”是指大气中直径小于或等于2.5 m(1
m(1 m=1×10-6m)的颗粒,“PM2.5”与空气形成的分散系属于胶体
m=1×10-6m)的颗粒,“PM2.5”与空气形成的分散系属于胶体
C.红宝石、水晶、玻璃、陶瓷等都是硅酸盐制品
D.分馏、裂化、裂解是利用化学变化来炼制加工石油的三种重要方法
查看答案和解析>>
科目: 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
设NA为阿佛加德罗常数的值,下列说法正确的是
A.0.2mol/LNa2S溶液中含有S2-数目为0.2NA
B.含1molH2SO4的浓硫酸和足量的铜完全反应,转移的电子数为2NA
C.某密闭容器盛有0.1molN2,0.3molH2,在一定条件下充分反应,转移的电子数为0.6NA
D.常温常压下5.6g乙烯和环丙烷的混合物中含有的碳原子数为0.4NA
查看答案和解析>>
科目: 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
根据下图的转化关系判断下列说法正确的是(反应条件已略去)

A.反应①②③④⑤均属于氧化反应和离子反应
B.反应⑤说明该条件下铝的还原性强于锰
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D.反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目: 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
下列解释实验事实的化学方程式正确的是
A.5molFe和4molCl2反应:5Cl2+4Fe点燃2FeCl2+2FeCl3
B.2molKMnO4和3molH2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=Mn2++4O2↑+6H2O
C.在电解液为氢氧化钾的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O
D.向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-
查看答案和解析>>
科目: 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,A在反应中既不容易得电子也不容易失电子,元素B的最外层电子数是电子层数的3倍,元素D与A为同族元素,元素C和E形成的化合物CE是海水中的主要成分。下列说法不正确的是
A.离子半径:r(E)>r(B)>r(C)
B.熔点:CE>DE4
C.C与B形成的两种化合物中化学键类型不同
D.A、D、E的最高价氧化物对应水化物的酸性逐渐增强
查看答案和解析>>
科目: 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
下列有关实验操作,现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将过量CO2通入CaCl2溶液中 | 无白色沉淀 | 生成Ca(HCO3)2溶于水 |
B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目: 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应如下:2A(g)+B(g) 2D(g) △H=-QKJ·mol-1。相关条件和数据见下表:
2D(g) △H=-QKJ·mol-1。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 800 | 800 | 850 |
达平衡时间/min | 40 | 10 | 30 |
c(D)平衡/mol·L-1 | 0.5 | 0.5 | 0.15 |
反应的能量变化/KJ | Q1 | Q2 | Q3 |
下列说法正确的是
A.可用压强或密度是否发生变化判断上述反应是否达到平衡
B.实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时υ(D)为0.01mol·L-1·min-1
C.由表中信息可知Q>O,并显有Q3<Q2=Q1=Q
D.实验Ⅰ达平衡后,恒温下再向容器中通入1molA和1molD,达平衡时c(D)为1.0mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com