
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:选择题
已知:2[NaAl(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2mol[NaAl(OH)4]的混合液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
选项 | A | B | C | D |
n(CO2)(mol) | 2 | 3 | 4 | 6 |
n(沉淀)(mol) | 1 | 2 | 3 | 3 |
查看答案和解析>>
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:填空题
(本题共12分)
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。
_________________________________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
查看答案和解析>>
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:填空题
(本题共12分)
硫在自然界中以游离态和多种化合态形成出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。
完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。_________________________________
(2)石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。_____________________、______________________
(3)室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
(4)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。__________________________
(5)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有____、______。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是______________。
查看答案和解析>>
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:实验题
(本题共12分)
氯气和氯乙烯都是重要的化工产品,年产量均在107t左右。氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
4)工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C CaC2+CO
CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、_____________________。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
查看答案和解析>>
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:填空题
(本题共8分)
许多有机化合物具有酸碱性。
完成下列填空:
(1)苯酚、苯甲醇、苯甲酸、碳酸的酸性由强到弱的顺序为:_____________________________________。苯胺(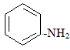 )具有______。(相同“酸性”、“碱性”或“中性”)
)具有______。(相同“酸性”、“碱性”或“中性”)
(2)常常利用物质的酸碱性分离混合液。某一混合液含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如下图:
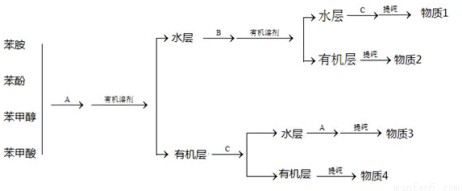
已知:苯甲醇、苯甲酸、苯胺微溶于水。
A、B、C分别是:A_______ B_________ C_____________
上述方案中,若首先仅仅将苯甲酸与其他三种物质分开,则应加入________。
(3)欲将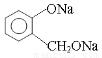 转化为
转化为 ,则应加入____________。
,则应加入____________。
查看答案和解析>>
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:填空题
(本题共14分)
M是一种治疗直肠癌和小细胞肺癌药物的主要成分,其结构式为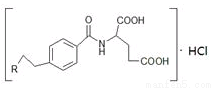 (不考虑立体结构,其中R为
(不考虑立体结构,其中R为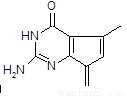 )。M的一条合成路线如下(部分反应试剂和条件略去)。
)。M的一条合成路线如下(部分反应试剂和条件略去)。
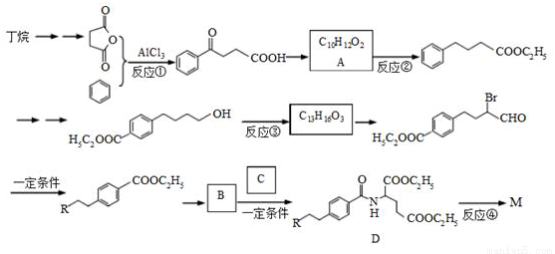
完成下列填空:
(1)写出反应类型。 反应①_________ 反应③__________
(2)写出反应试剂和反应条件。反应②_________ 反应④__________
(3)写出结构简式。 B_____________ C_____________
(4)写出一种满足下列条件的A的同分异构体的结构简式。
(1)能与FeCl3溶液发生显色反应;(2)能发生银镜反应;(3)分子中有5种不同化学环境的氢原子。
(5)丁烷氯代可得到2-氯丁烷,设计一条从2-氯丁烷合成1,3-丁二烯的合成路线。
(合成路线常用的表示方法为:A B……
B…… 目标产物)
目标产物)
(6)已知:R-CO-NHR′与R-CO-OR′的化学性质相似。
从反应④可得出的结论是:_______________________。
查看答案和解析>>
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:计算题
(本题共14分)
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为________mol/。
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
查看答案和解析>>
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(全国大纲卷解析版) 题型:选择题
下列叙述正确的是
A.锥形瓶可用作加热的反应器
B.室温下,不能将浓硫酸盛放在铁桶中
C.配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高
D.用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低
查看答案和解析>>
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(全国大纲卷解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A. lmol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L0.5 mol ? L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na202固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6 NA
查看答案和解析>>
科目: 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(全国大纲卷解析版) 题型:选择题
下列叙述错误的是
A. SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KC1和KI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com