
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
25℃时,水中存在电离平衡: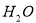

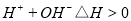 。下列叙述正确的是
。下列叙述正确的是
A.将水加热,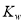 增大,
增大,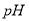 不变
不变
B.向水中加入少量NaHSO4固体,c(H+)增大,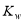 不变
不变
C.向水中加入少量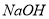 固体,平衡逆向移动,
固体,平衡逆向移动,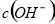 降低
降低
D.向水中加入少量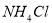 固体,平衡正向移动,
固体,平衡正向移动,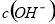 增大
增大
查看答案和解析>>
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
在室温下,下列叙述正确的是
A.将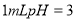 的一元酸溶液稀释到
的一元酸溶液稀释到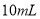 ,若溶液的
,若溶液的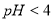 ,则此酸为弱酸
,则此酸为弱酸
B.将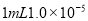
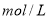 盐酸稀释到
盐酸稀释到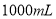 ,得到
,得到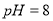 的盐酸
的盐酸
C. 用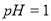 的盐酸分别中和
的盐酸分别中和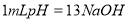 溶液和氨水,
溶液和氨水,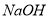 消耗盐酸的体积大
消耗盐酸的体积大
D. 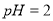 的盐酸与
的盐酸与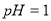 的硫酸比较,
的硫酸比较,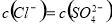
查看答案和解析>>
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
下列叙述中,正确的是
A.用惰性电极电解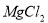 溶液分别得到单质
溶液分别得到单质 和Cl2
和Cl2
B.常温下,某溶液中由水电离出的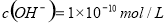 ,该溶液一定呈酸性
,该溶液一定呈酸性
C.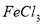 溶液和
溶液和 溶液加热蒸干、灼烧都得到
溶液加热蒸干、灼烧都得到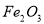
D.在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低
查看答案和解析>>
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
大气污染问题已成影响环境的重要因素,有人想利用2CO(g)+SO2(g) 2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
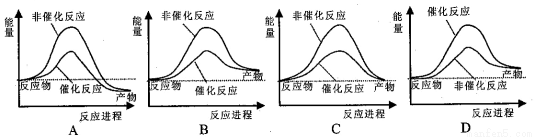
查看答案和解析>>
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压,高铁电池的总反应为
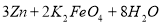

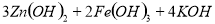
下列叙述不正确的是
A.充电时阳极反应为:
B.放电时负极反应为:
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
关于图中各装置的叙述不正确的是
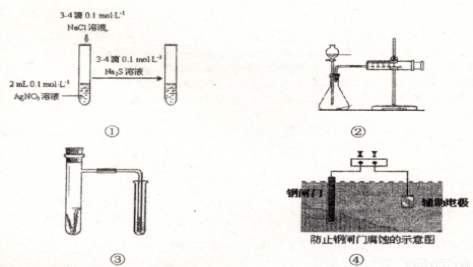
A. 装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B. 装置②能测量锌与硫酸的反应速率
C. 装置③能验证铁的吸氧腐蚀
D. 装置④的X电极是负极,则能验证外接电源的阴极保护法
查看答案和解析>>
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g) ΔH<0。达到化学平衡后测得A的浓度为0.20 mol·L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.35 mol·L-1。则下列有关判断正确的是
zC(g) ΔH<0。达到化学平衡后测得A的浓度为0.20 mol·L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.35 mol·L-1。则下列有关判断正确的是
A.平衡向逆反应方向移动了 B. x+y>z
C.B的转化率下降 D.C的体积分数减小
查看答案和解析>>
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
下列解释实际应用的原理表达式中,不正确的是
A. 用排饱和食盐水法收集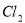 :
: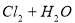

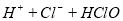
B. 热的纯碱溶液碱性增强: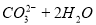

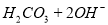
C. 向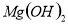 悬浊液中加入
悬浊液中加入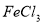 溶液:
溶液: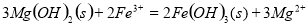
D. 配制FeCl3溶液时为防止溶液浑浊常加入少量稀盐酸Fe3++3H2O Fe(OH)3+3H+,
Fe(OH)3+3H+,
查看答案和解析>>
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:填空题
(6分)水溶液中存在水的电离平衡。
(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于 。
(2)用“>”、“<”或“=”填空: 碱性溶液中,c(H+) c(OH-),在常温时pH 7。
(3)有下列几种溶液:A. NH3·H2O B. CH3COONa C. NH4Cl D. NaHSO4
常温下呈酸性的溶液有 (填序号)
用离子方程式或电离方程式表示这些溶液呈酸性的原因:___________________________________。
查看答案和解析>>
科目: 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:填空题
(9分) I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________ ___。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c __0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)________c(Na+)(选填“>”、“<”或“=”)
从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是______________________________________。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。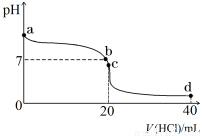
(1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com