
科目: 来源: 题型:
| A、只有①②③ | B、只有②③④ | C、只有①③④ | D、全部 |
查看答案和解析>>
科目: 来源: 题型:
| A、反应前酸、碱溶液的温度要相同 | B、测量溶液的温度计要一直插在溶液中 | C、为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | D、为了使反应更完全,可以使酸或碱适当过量 |
查看答案和解析>>
科目: 来源: 题型:
| A、②④⑤ | B、①③⑥ | C、①③④ | D、③⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:
| A、容量瓶、滴定管、烧杯、蒸馏烧瓶、量筒等仪器上都具体标明了使用温度 | B、KNO3晶体中含有少量NaCl可利用重结晶的方法提纯 | C、冷浓硫酸保存在敞口的铝制的容器中 | D、为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 |
查看答案和解析>>
科目: 来源: 题型:
| A、①②③④ | B、②③④ | C、③④ | D、①④ |
查看答案和解析>>
科目: 来源: 题型:
| A、容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | B、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 | C、用纸上层析法检验氯化铁溶液中是否混有少量氯化铜 | D、硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分摩擦器皿壁促使晶体析出 |
查看答案和解析>>
科目: 来源: 题型:
| 高温 |
| 催化剂 |
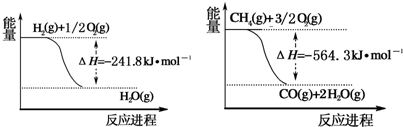
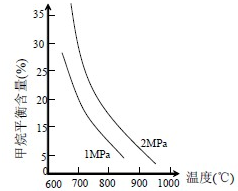
| n(H2O) |
| n(CH4) |
查看答案和解析>>
科目: 来源: 题型:
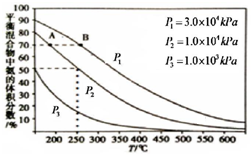 目前工业合成氨的原理是:
目前工业合成氨的原理是:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
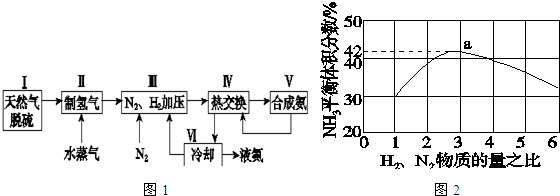
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com