
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 试剂 | ①H2SO4②KMnO4 ③KI ④AgNO3 ⑤淀粉溶液 |
| 发生的现象 | A:生成白色沉淀 B:溶液显蓝色 C:溶液紫色褪去 |
查看答案和解析>>
科目: 来源: 题型:
| 亚硝酸钠(NaNO2) | 氯化钠(NaCl) | |
| 水溶性 | 易溶,溶液呈弱碱性 | 易溶,溶液呈中性 |
| 熔点 | 271℃ | 801℃ |
| 沸点 | 320℃会分解 | 1413℃ |
| 跟稀盐酸作用 | 有红棕色的NO2气体放出 | 无反应 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
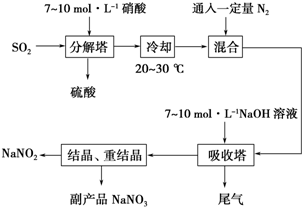
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 2 |
| 3 |
| 2 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com