
科目: 来源: 题型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
| A、C7H16 |
| B、C7H14O2 |
| C、C8H18 |
| D、C8H18O |
查看答案和解析>>
科目: 来源: 题型:
| A、该烃的名称:2-乙基-1-丁烯 | B、该烃与氢气加成得到的烷烃的名称:3-甲基戊烷 | C、该烃能使溴的四氯化碳溶液褪色,不能与溴发生取代反应 | D、该烃能在一定条件下与HCl加成,得到两种卤代烃 |
查看答案和解析>>
科目: 来源: 题型:
| A、由于水分子间存在氢键,所以稳定性:H2O>H2S | B、由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 | C、若弱酸HA的酸性强于弱酸HB,则同温度、同浓度钠盐溶液的碱性:NaA<NaB | D、若R2-和M+的电子层结构相同,则原子半径R>M |
查看答案和解析>>
科目: 来源: 题型:
| A、①④⑤⑥ | B、①②③④⑤ | C、①④ | D、①②③ |
查看答案和解析>>
科目: 来源: 题型:
| A、水凝结成冰时,密度变小 | B、DNA分子中两条链能形成双螺旋结构 | C、水在2000℃时,只有4%的H2O发生分解 | D、氨分子与水分子形成一水合氨 |
查看答案和解析>>
科目: 来源: 题型:
| A、分子晶体中分子间作用力越大,分子越稳定 | B、原子晶体中共价键越强,则晶体的熔点越高 | C、冰融化时水分子中H-O键未发生断裂 | D、冰的密度比液态水的密度小与水分子间的氢键有关 |
查看答案和解析>>
科目: 来源: 题型:
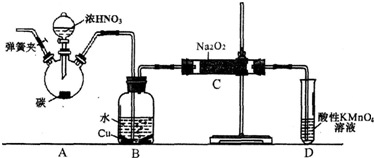
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com