
科目: 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:选择题
下列实验中,依据实验操作及现象,得出的结论正确的是( )
| 操 作 | 现 象 | 结 论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化 但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
C | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或 HCO3- |
查看答案和解析>>
科目: 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:选择题
用下列实验装置进行的实验中,说法正确的是( )
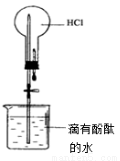
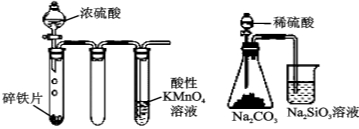

实验① 实验② 实验③ 实验④
A.实验①:打开止水夹,烧瓶内出现红色喷泉
B.实验②:铁片最终完全溶解,且高锰酸钾溶液褪色
C.实验③:所示实验可比较硫、碳、硅三种元素的非金属性强弱
D.实验④:烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊
查看答案和解析>>
科目: 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:填空题
(8分)1814年戴维发现了一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。
(1)氯元素在元素周期表中的位置是____________________;ICl的电子式为____________。
(2)ICl与冷的NaOH稀溶液反应的离子方程式为________________________________。
(3)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,发生反应的化学方程式为_____。
(4)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的相对质量分别为198和269,其电离方程式为_________________________。
查看答案和解析>>
科目: 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:实验题
(15分)实验室常用的几种气体发生装置如图A、B、C所示:
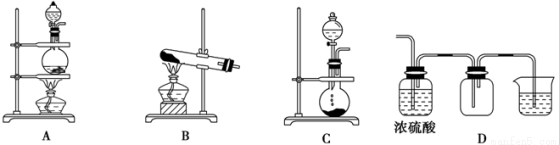
(1)实验室可以用B或C装置制取氨气:
Ⅰ、如果用B装置,通常使用的药品是________________;
Ⅱ、如果用C装置,通常使用的药品是________________________;
Ⅲ、检查B装置气密性的操作方法是____________________________________________。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是_____(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。
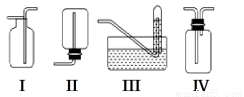
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
Ⅰ、写出A装置中反应的离子方程式____________________________________。
Ⅱ、D装置中连接小烧杯中应盛放___________,目的是_____________________________。
Ⅲ、若要收集干燥纯净的X气体,上述装置应如何改进:____________________________________。
查看答案和解析>>
科目: 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:实验题
(11分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
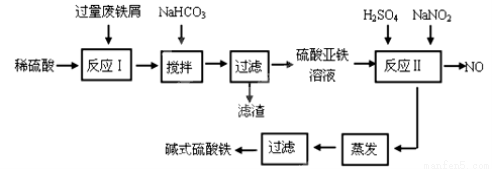
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1) 加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中的离子方程式为 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目: 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:实验题
(14分)用霞石岩(化学式为 KNa3[AlSiO4]4 ,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:

已知:①NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。
②溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见下图。

试回答下列问题:
(1)灼烧得到固体M的化学方程式是_______________。
(2)X物质是___________,滤液W中主要含有的离子有____________。(写三种)
(3)操作Ⅰ得到碳酸钠晶体的操作为 、 、 、洗涤、干燥。
(4)碳酸化Ⅰ中发生主要反应的离子方程式是_______________________________。
(5)碳酸化Ⅱ调整pH=8的目的是________________________________________________。
查看答案和解析>>
科目: 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:实验题
(16分)Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1)S2O32-能被I2氧化为S4O62-; (2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ、市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
实验步骤 | 预期现象或结论 |
步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
步骤2: |
|
步骤3: |
|
Ⅱ、利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
② 滴定:取10.00mL 0.01mol·L-1 K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③ 往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+ I2 === S4O62-+ 2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1) 步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2) 完成并配平步骤②中的离子反应: Cr2O72- + ( ) + I-= I2 + Cr3+ + H2O。
(3) 步骤③中,指示剂最好选用 ,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是 。
(4) 若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 。
查看答案和解析>>
科目: 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
材料与化学密切相关,表中对应关系错误的是( )
选项 | 材料 | 主要化学成分 |
A | 刚玉、金刚石 | 三氧化二铝 |
B | 大理石、石灰石 | 碳酸钙 |
C | 普通水泥、普通玻璃 | 硅酸盐 |
D | 沙子、石英 | 二氧化硅 |
查看答案和解析>>
科目: 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.S在纯氧中燃烧可生成SO3
B.用澄清石灰水可鉴别CO2和SO2
C.SO2能使KMnO4溶液褪色
D.CO2通入CaCl2溶液中能产生白色沉淀
查看答案和解析>>
科目: 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.78gNa2O2固体中含有的阴离子数为NA
B.标准状况下,2.24L氖气所含原子数为0.2NA
C.1 mol Cl2与足量Fe反应,转移的电子数为3NA
D.标准状况下,2.24L己烷含有碳原子的数目为0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com