
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(8分)肼(N2H4)是火箭发射常用的燃料。一种以肼(N2H4)为燃料的电池装置如图所示。 该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。
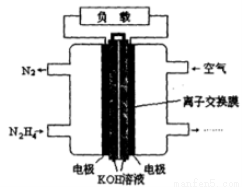
(1)负极上发生的电极反应为_________________;
(2)电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。
(3)放电一段时间后,右侧溶液的pH (填“变大”或“变小”)
查看答案和解析>>
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液。
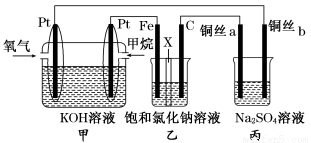
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是: 。
(2)石墨电极(C)的电极反应式为______________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为___ L。
(4)铜丝a处在开始一段时间的现象为______________;原因是________________________________________________________________________。
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
a.电能全部转化为化学能
b.粗铜接电源正极, 发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为____________________________。
查看答案和解析>>
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(12分)运用化学反应原理研究元素及其化合物的反应有重要意义。
工业合成氨过程中,N2和H2反应生成NH3:N2(g)+3H2(g) 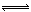 2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
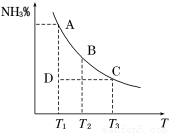
(1)N2(g)+3H2(g) 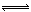 2NH3(g)的ΔH________0(填“>”或“<”)。
2NH3(g)的ΔH________0(填“>”或“<”)。
(2)若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不移动”) 。
(3)若温度为T1时,反应进行到状态D时,v正_____v逆(填“>”、“<”或“=”)。
(4)在体积为5 L的恒温、恒容密闭容器中,起始时投入2 mol N2、3 mol H2,经过10 s达到平衡,测得平衡时NH3的物质的量为0.8 mol。
①达平衡时N2的转化率=________。
②容器中反应的逆反应速率随时间变化的关系如图。
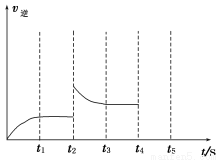
t2时改变了某一种条件,改变的条件可能是__________、____________________(填写两项)。
查看答案和解析>>
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(12分)甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。
(1)已知在常温常压下:
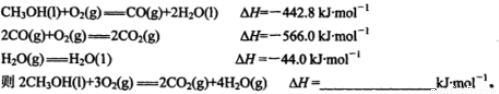
(2)工业上正在研究利用CO2和H2来生产甲醇燃料的方法,该反应为:
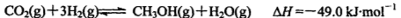
在某温度下,将6mol CO2和8mol H2 充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%。请回答:
①用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH) = .
②此温度下该反应平衡常数K=____________;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后H2的转化率_________75% (填“大于”、“小于”或“等于”)。
(3) 一氧化碳与氢气也可以合成甲醇: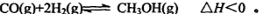
①若该反应在恒温恒容条件下进行,下列说法正确的是 ;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的焓变不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数
K=50 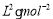 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:

请比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
“化学与社会、生活、科研密切的关系”。下列叙述中,不正确的是
A.大量使用燃煤发电是形成雾霾的主要原因
B.天然气、煤气大量泄漏遇到明火会爆炸
C.利用化学反应可实现12C到14C的转化
D.晶体硅可用于光伏发电、制造芯片
查看答案和解析>>
科目: 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列叙述正确的是
A.元素的单质可由氧化或还原含该元素的化合物来制得
B.得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得到电子被还原,只能做氧化剂
D.含有最高价元素的化合物一定具有强的氧化性
查看答案和解析>>
科目: 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列有关实验的做法错误的是
A.用苯从溴水中提取溴,有机层从分液漏斗的上口倒出
B.实验室可以用浓氨水和生石灰制备NH3
C.实验室中用加热方法分离碘和食盐的混合物
D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
查看答案和解析>>
科目: 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列叙述正确的是
A.非金属氧化物一定不是碱性氧化物
B.HCl、H2S、NH3都是电解质
C.漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用于物质分离
D.Fe(OH)3、FeCl2、CuS都不能直接用化合反应制备
查看答案和解析>>
科目: 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸; ②用酒精洗涤粘有硫粉的试管;
③用托盘天平称量10.1 g氯化钠晶体; ④用饱和NaHCO3溶液除之CO2中的少量SO2;
⑤用瓷坩埚熔融NaOH固体; ⑥实验中不慎将手指划破,可立即用FeCl3溶液止血
A.①②③④ B.③④⑥
C.③④⑤ D.③⑤⑥
查看答案和解析>>
科目: 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列实验装置、选用的试剂或实验操作中,都正确的是
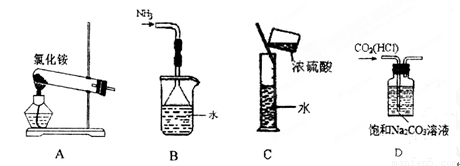
A.实验室用装置A制取氨气 B.用B装置吸收氨气,并防止倒吸
C.用C装置稀释浓硫酸 D.用D装置除去CO2中的HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com