
科目: 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:填空题
(16分)化学学习中要注重对过程的分析,按要求回答下列问题:
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式____;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式________。
(2)将一小块钠投入到盛氯化铵的溶液中,有氨气生成,其反应过程分为两步,其中第二步反应的离子方程式为__________。
(3)过氧化钠与干燥的二氧化碳不反应,与湿润的二氧化碳反应生成氧气,则该过程的两个反应方程式分别为___________________、__________________。
(4)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是__________、_________。
(5)向含1molFeBr2的溶液中通入______L(标准状况下)氯气,才能将Fe2+全部转化为Fe3+。(6)足量的铜与一定体积的浓硫酸反应,反应后溶液中所含的溶质有______(填化学式)。
查看答案和解析>>
科目: 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:填空题
(14分)下列问题均涉及到化学学科重要的思想和观点,按要求回答下列问题:
(1)量变和质变的观点:①锌与稀硫酸反应生成氢气,当硫酸浓度逐渐增大到一定程度时,可生成的气体是_____(填化学式,下同);②铜与稀硝酸反应生成一氧化氮,当硝酸浓度逐渐增大到一定程度时,可生成的气体是____;③稀盐酸的还原性较弱,与二氧化锰不反应,浓盐酸的还原性增强,与二氧化锰在加热的条件下发生的反应方程式为_____。
(2)微粒观:①18g2H2O中所含质子的物质的量为____,所含的中子数为____;②Na2O2、Na2O中阳离子和阴离子个数比分别为______、_____。
(3)守恒的思想:①由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8 mol·L-1,则c(K+)为______;②mM+nH++O2=xM2++yH2O,则x值为________。③ClO2与Cl2均有强氧化性,在处理废水的过程中自身均被还原为Cl-,在处理相同量的废水时,所需要ClO2的物质的量是Cl2的____倍。
查看答案和解析>>
科目: 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:填空题
(17分)按要求回答下列问题:
(1)实验室铝粉和Fe2O3作铝热反应实验,铝热反应的方程式为_________,该实验中除用到铝粉和Fe2O3外,需要的试剂还有 (填编号)。
a.KClO3 b.Mg c.MnO2 d.KCl
(2)据文献报道,在实际反应中铝热反应的产物成分较为复杂。某课题组对铝热反应产物的成分进行探究,经成分分析,发现主要得到甲和乙两种产物。甲由具有相同电子层结构的阴、阳离子构成;乙是一种铁铝的金属互化物(可用FexAly表示),取该合金粉末2.47g,滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体在空气中充分加热、灼烧得红棕色粉末1.60g。
①甲的化学式为______,乙中x=_____,y=_______。
②甲的晶体是耐高温材料,用此材料做成的坩埚,不能用来熔融NaOH,用化学方程式解释其原因______;含二氧化硅材料做成的坩埚_____(填“能”或“不能”)用来熔融NaOH。
③下图表示室温下相同组分的乙分别在两种不同的酸中的腐蚀情况,
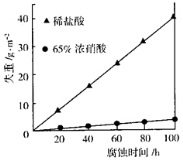
由图可知,乙在______中具有比较强的抗腐蚀性,原因可能是______。
④研究发现铝热反应后期温度高达2000℃以上时会有极微量的Al4C3生成,Al4C3遇水会产生一种气体,该气体的分子式为________。[已知CaC2+2H2O=Ca(OH)2+C2H2↑]
(3)镁铝互化物(Mg17Al12)是一种潜在的贮氢材料,该金属互化物在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al。得到的混合物在6.0 mol·L-1 HCl中,能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为________。
查看答案和解析>>
科目: 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:实验题
(18分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
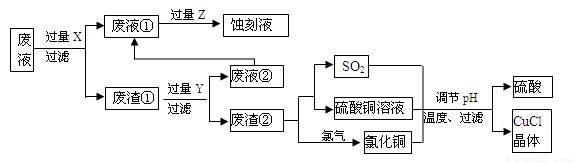
按要求回答下列问题:
(1)废液①的主要含有的金属阳离子是_____(填化学符号,下同);废渣①的主要含有的物质是________;Y为_______。
(2)检验Z过量的方法是______________________________。
(3)写出废渣②生成二氧化硫的化学方程式___________________________。
(4)为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
(5)生产过程中调节溶液的pH不能过大的原因是____________________________。
(6)写出产生CuCl的离子方程式___________________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g加入10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;
②待样品溶解后,加水50ml和2滴指示剂;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 =CuCl2 + FeCl2;Fe2+ + Ce4+ = Fe3+ + Ce3+。则CuCl的纯度为____________。
查看答案和解析>>
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.电解质溶液导电的过程实际上就是电解的过程
B.利用电解饱和食盐水所得的产物可以生产盐酸
C.化学反应的限度越大,则所有反应物的转化率就一定越大
D.氢氧燃料电池的负极通入的是氢气
查看答案和解析>>
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
反应:L(s)+aG(g) bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断

A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.无法判断a,b大小
查看答案和解析>>
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g) = N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH<0
C.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
铅蓄电池是一种用途极广的二次电池,其电池反应为:
下列说法不正确的是
A.放电时,负极质量增加
B.充电时,应将外接直流电源的正极与蓄电池的铅电极相接
C.放电时,正极反应为:
D.铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
查看答案和解析>>
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.增大反应物浓度,可逆反应正速率增大;减少反应物浓度,可逆反应逆速率增大
B.粗铜精炼时,电解质液中的c(Cu2+)保持不变
C.纯银在空气中久置变黑发生的是电化学腐蚀
D.阴极电保护法是将被保护的金属与外加电源的负极相连
查看答案和解析>>
科目: 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
下列说法正确的是( )
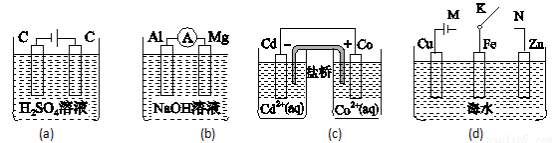 A.图(a)中,随着电解的进行,溶液中H+的浓度越来越小
A.图(a)中,随着电解的进行,溶液中H+的浓度越来越小
B.图(b)中,Mg电极作电池的负极
C.图(c)中,发生的反应为Co+Cd2+= Cd+Co2+
D.图(d)中,K分别与M、N连接时,Fe电极均受到保护
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com