
科目: 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:实验题
(本小题14分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
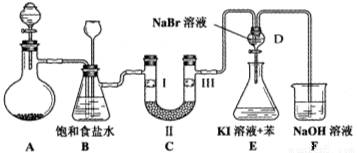
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:________________________。
(2)装置B中饱和食盐水的作用是________________________________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入__________。
| A | B | C | D |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是 。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_______________________________。
(5)某同学建议将装置F中的药品改用足量的NaHSO3溶液吸收余氯,老师认为不妥,用总反应的离子方程式解释原因_____________________________________。
查看答案和解析>>
科目: 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:填空题
(本小题16分)高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。某研究小组设计了用工业废铁屑(含铜、碳、硅等)制取高铁酸钠的工艺流程,其中X、Y、Z是含铁化合物。
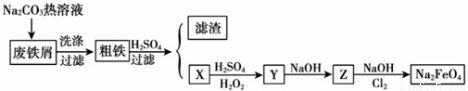
(1)废铁屑中加入碳酸钠热溶液的目的__________________________________。
(2)试写出上述过程中X转 化 为Y的离子方程式_____________________________________。
(3)写出Cl2将Z氧化为Na2Fe O 4的化学方程式________________________________。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理_____________________________。
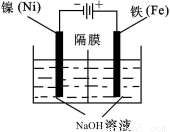
(5)电化学法制备高铁酸钠采用铁片作阳极,浓NaOH溶液作为电解质溶液(如下图所示),试写出阳极的电极反应式: ;总电解反应离子方程式为_____ 。电解一段时间后,收集到某种气体标况下为3.36L,则获得高铁酸钠的物质的量为 ,阳极区周围溶液的pH________(填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目: 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
分类是科学研究的重要方法,下列物质属于电解质的是
A.Cu B.CO2 C.冰醋酸 D.氨水
查看答案和解析>>
科目: 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
下列关于能源的说法不正确的是
A.煤的干馏是物理变化,煤的气化和液化是化学变化
B.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
C.沼气(主要成分是CH4)是可再生能源
D.太阳能、氢能、风能、地热能、生物质能都是新能源
查看答案和解析>>
科目: 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述中,正确的是
A.标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA
B.7g CnH2n中含氢原子数为NA
C.78 g 过氧化钠与CO2反应,转移电子数为2NA
D.25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA
查看答案和解析>>
科目: 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C =2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
科目: 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
某未知溶液中已检验出含有离子Ca2+、NO3-,且pH=2。欲检验此溶液中是否大量存在以下6种离子:①ClO- ②NH4+ ③I- ④Fe2+ ⑤AlO2- ⑥Cl-,其中不必检验就能排除的离子是
A.②③⑤⑥ B.①③④⑤
C.①④⑤⑥ D.①②③④
查看答案和解析>>
科目: 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
结合图判断,
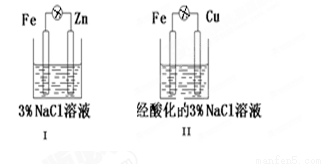
下列叙述正确的是
A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中Cl- 均向Fe电极移动
C.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
D.Ⅰ和Ⅱ中正极反应均是O2+4e-+2H2O=4OH-
查看答案和解析>>
科目: 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:填空题
(8分)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+ Cl2↑+2H2O
(1)氧化剂是________, 氧化产物是________。
(2)浓盐酸在反应中显示出来的性质是________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1mol Cl2,则转移电子的物质的量为________mol。
(4)将分离出来的氯气常温下通入NaOH,可以得到漂白液,反应的离子方程式为___________________________________________________。
查看答案和解析>>
科目: 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:填空题
(7分) 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)这三种氧化物中,属于酸性氧化物的是____________(用化学式表示)。
(2)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+8NH  7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(3)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1= - 196.6 kJ·mol-1
2SO3(g) ΔH1= - 196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2= - 113.0 kJ·mol-1
2NO2(g) ΔH2= - 113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的 ΔH3= kJ·mol-1。
SO3(g)+NO(g)的 ΔH3= kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com