
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
在含有酚酞的0.1 mol·L-1氨水中加入少量的NH4Cl晶体,则溶液颜色
A.变蓝色 B.变深 C.变浅 D.不变
查看答案和解析>>
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.NH4NO3
查看答案和解析>>
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
有①②③三瓶体积相等,浓度都是1 mol·L-1的HCl溶液,将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体,(加入后溶液仍呈强酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液体积是
A.①=③>② B.③>②>①
C.③=②>① D.①=②=③
查看答案和解析>>
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是
A.HCN+CO32- = CN-+ HCO3-
B.2HCOOH+CO32- = 2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
查看答案和解析>>
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
下列实验误差分析错误的是
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A.W2-、X+ B.X+、Y3+ C.Y3+、Z2- D.X+、Z2-
查看答案和解析>>
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a ,c(M2+)=b mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq) Ksp=a ,c(M2+)=b mol·L-1时,溶液的pH等于
A.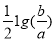 B.
B.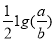 C.14+
C.14+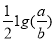 D.14+
D.14+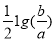
查看答案和解析>>
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:填空题
(12分)Ⅰ.已知可逆反应:M(g)+N(g)  P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;
达到平衡后,c(P)=2 mol·L-1,a=____________。
Ⅱ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应
A(g) B(g)+C(g) △H=+85.1kJ·mol-1
B(g)+C(g) △H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为_ ,列式并计算反应的平衡常数K 。
查看答案和解析>>
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)(1)通过NOx传感器可监测NOx的含量,固体体电解质可以传导O2-其工作原理示意图如下:
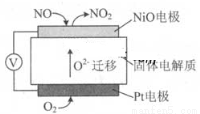
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
(2)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
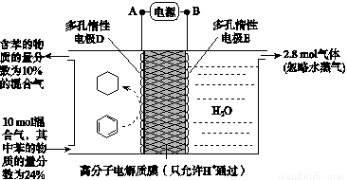
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目: 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com