
科目: 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:填空题
(9分)某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。试回答下列问题:
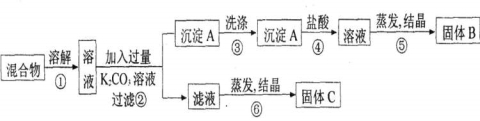
(1)B物质的化学式为 。
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步骤是 (填序号)改进措施是: 。
(3)写出K2CO3的电离方程式: 。
(4)写出②④两步中对应的离子方程式:
②_______________________________________________________________
④_______________________________________________________________
查看答案和解析>>
科目: 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:填空题
(6分)(1)已知0.1mol/L的NaHSO4溶液中H+ 的物质的量浓度为0.1mol/L,请回答下列问题:
①写出NaHSO4在水溶液中电离的方程式:___________________________________。
②若将NaHSO4与Ba(OH)2在溶液中按物质的量比为2:1混合,反应的离子方程式是:___________________________________________________________。
若将NaHSO4与Ba(OH)2在溶液中按物质的量比为1:1混合,反应的离子方程式是:___________________________________________________________。
查看答案和解析>>
科目: 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:填空题
(14分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是_____,该反应的还原产物是_____。
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是_____,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是_____mol。
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96 L,则被还原的硝酸的物质的量是_____ mol,参加反应的硝酸的物质的量是_____mol,产生的混合气体中NO和NO2体积比为_______。
查看答案和解析>>
科目: 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:实验题
(13分)表示溶液浓度的方法通常有两种:溶液中溶质的质量分数(ω)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.00g·cm-3)的NaOH溶液配制成27.5g2%的NaOH溶液。
①计算:需______g10%(密度为1.00g·cm-3)的NaOH溶液,需加______mL水(密度为1.00g·cm-3)进行稀释。
②量取:用_______mL量筒(可供选择的量筒规格有:5mL、10mL、25mL、50mL,下同)量取10%的NaOH溶液,量取时视线要跟量筒内液体_______相切,然后倒入烧杯里,用______mL量筒量取蒸馏水注入烧杯里。
(2)把98%(密度为1.84g·cm-3)的浓硫酸稀释成3 mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸___________mL(保留一位小数)。
②配制操作可分解成如下几步,正确的操作顺序是:___________。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线
③如果上述C操作中把未冷却的稀硫酸注入容量瓶中,所配溶液的浓度将_________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中量取浓硫酸后量筒内滞留的浓硫酸用少量蒸馏水洗涤并将洗涤液转入E操作中的小烧杯中,所配溶液的浓度将_________;如果上述G操作中目光仰视,所配溶液的浓度将_________;如果上述D操作中目光俯视,所配溶液的浓度将_________。
(3)实验室用NaOH固体配制1mol/L的NaOH溶液和用98%(密度为1.84g·cm-3)的浓硫酸配制1mol/L的H2SO4溶液各100mL。
①配制1mol/L的NaOH溶液,在用托盘天平称取NaOH固体时,天平读数为_______(填代号,下同)。
A.4.0g B.小于4.0g C.大于4.0g
②配制1mol/L的 H2SO4溶液,在烧杯中稀释浓硫酸的正确操作是: 。
查看答案和解析>>
科目: 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:计算题
(6分)在标准状况下,用一定量的水吸收氨气后得到浓度为12.0 mol/L密度为0.915g·cm-3的氨水,试计算(要求写出计算过程):
(1)该氨水溶质的质量分数ω是多少?(用百分数表示,保留到小数点后一位数)
(2)1 L水吸收标准状况下的氨气多少升可制得上述氨水?(水的密度以1.00g·cm-3计,计算结果取整数。)
查看答案和解析>>
科目: 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
对于反应方向的判断,下列不正确的是
A.ΔH<0,ΔS>0,所有温度下反应自发进行
B.ΔH>0,ΔS>0,所有温度下反应自发进行
C.ΔH<0,ΔS<0,低温下反应自发进行
D.ΔH>0,ΔS<0,所有温度下反应不能自发进行
查看答案和解析>>
科目: 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
一定量的稀硫酸与过量的锌反应,为减慢反应速率,且不影响生成氢气的总量,可向稀硫酸中加入适量的下列物质,其中一定不能达到目的的是
A.硫酸铜固体 B.水 C.醋酸钾溶液 D.氯化钠溶液
查看答案和解析>>
科目: 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
可逆反应2SO2(g)+O2(g)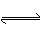 2SO3(g),在不同条件下测得化学反应速率最快的为
2SO3(g),在不同条件下测得化学反应速率最快的为
A.v(O2)=3 mol·L-1·min-1
B.v (SO2) =4 mol·L-1·min-1
C.v (SO3) =0.1 mol·L-1·s-1
D.v (O2) =0.1 mol·L-1·s-1
查看答案和解析>>
科目: 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
化学反应N2+3H2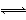 2NH3的能量变化如图所示,该反应的热化学方程式是
2NH3的能量变化如图所示,该反应的热化学方程式是
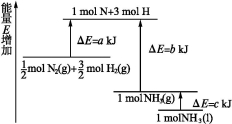
A.N2(g)+H2(g) = NH3(l) ΔH=+(b+c-a) kJ·mol-1
B.N2(g)+3H2(g) = 2NH3(g) ΔH=+2(b-a) kJ·mol-1
C.N2(g)+3H2(g) = 2NH3(l) ΔH=-2(b+c-a) kJ·mol-1
D.N2(g)+H2(g) = NH3(g) ΔH=+(a+b) kJ·mol-1
查看答案和解析>>
科目: 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
已知:断裂下列化学键需要吸收的能量分别为:H-H 436 kJ/mol;F—F 153 kJ/mol;H—F 565 kJ/mol。下列说法正确的是
A.H2与F2反应的热化学方程式为:H2(g) + F2(g)= 2HF(g); △H = -541 kJ
B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com