
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C是金属元素,B是地壳中含量最多的元素,A元素常见化合价为+1和-1;A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍。下列叙述正确的是
A.元素的原子半径:A<B<C<D< E
B.对应氢化物的热稳定性:D > E
C.B与C、B与D形成的化合物中化学键类型相同
D.五种元素中最高价氧化物对应的水化物酸性最强的是E
查看答案和解析>>
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0
D.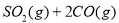

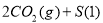 达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高
达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高
查看答案和解析>>
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
国庆期间对天安门广场大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
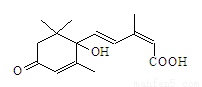
A.其分子式为C15H18O4
B.1mol该物质与NaOH溶液反应,最多可消耗2mol NaOH
C.既能发生加成反应,又能发生取代反应和消去反应
D.既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有SO42- |
C | 用洁净铂丝蘸取某溶液置于酒精灯火焰上灼烧 | 火焰呈黄色 | 溶液中含Na+,无K+ |
D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y一定是Cl2 |
查看答案和解析>>
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列有关溶液中微粒浓度关系的叙述正确的是
A.0.1 mol·L-1NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3—)+c(H2CO3)+c(CO32—)
C.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
D.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)=c(NH4+)=c(Cl-)
查看答案和解析>>
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
温度为T时,向2.0 L恒容密闭容器中充入2.0 mol NO2,反应2NO2(g) N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(N2O4)/mol | 0 | 0.12 | 0.18 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(NO2)=0.001 2 mol·L-1·s-1
B.保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)<v(逆)
C.保持其他条件不变,升高温度达到新平衡时K=0.125,则反应的ΔH<0
D.T温度时,若起始向容器中充入2.0 mol N2O4,则平衡时N2O4的转化率大于80%
查看答案和解析>>
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:填空题
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:

(1)碱浸时为提高铝土矿的浸出率可采取的措施是 , 。(答两点)
(2)AlO(OH)与NaOH反应的化学方程式为 。
(3)在稀释、结晶过程中,加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的某气体的方法来代替。通入气体时发生反应的离子方程式是 .
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: 。
(5)该生产流程能实现 (填化学式)的循环利用。
(6)氧化铝是工业上冶炼铝的原料,用氧化铝电解制备金属铝时需加入冰晶石(Na3AlF6)作助熔剂,写出用NaF和Al2(SO4)3反应制备冰晶石的化学方程式为 。
查看答案和解析>>
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:实验题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
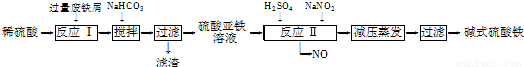
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)流程中加入少量NaHCO3的目的是调节pH,使溶液中的___________(填“Fe3+”“Fe2+”或“Al3+”)沉淀,则调节pH的范围是___________________.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作______。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。用NaNO2的缺点是产生NO污染,若用双氧水代替NaNO2发生反应的离子方程式是 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)聚合离子。该水解反应的离子方程式为____________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
查看答案和解析>>
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:填空题
水滑石(MgaAlb(OH)c(CO3)d·xH2O)用作阻燃剂及催化剂的载体
(1)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为 。
(2)为确定水滑石的组成,进行如下实验:取水滑石样品60.2g进行加热时,温度与剩余固体质量的关系如图。认真分析图中曲线变化情况回答下列问题(已知样品在400℃时已完全失水)
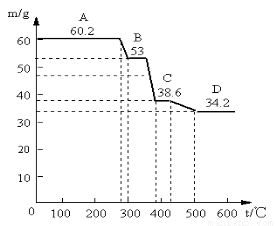
①当温度在0~280℃质量不变,是什么原因: 。C→D减少的物质其物质的量为
②该水滑石的化学式为 (写出计算过程)
查看答案和解析>>
科目: 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:实验题
NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:

请回答下列问题:
(1)溶解废渣常用一定浓度的稀硫酸,用浓硫酸配制一定浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式: 。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,除去铁还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp = 2.64×10?39)。下列说法正确的是______(选填序号)。
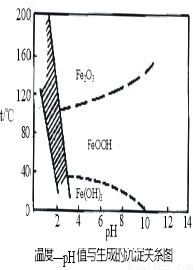
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?27
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_________________。
(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是 。
(6)操作Ⅰ的实验步骤依次为:【实验中可选用的试剂:6mol?L-1的H2SO4溶液,蒸馏水、pH试纸】。
①__________________________________;
②__________________________________;
③ ;
④用少量乙醇洗涤NiSO4?6H2O晶体并晾干。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com