
科目: 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)水泥是一种重要的建筑材料,水泥的强度是评价水泥质量的重要指标,它与水泥中CaO的含量有着良好的相关性,因此在特殊情况下可以通过测定其中Ca0的含量预测水泥的强度。为测量某品牌水泥中氧化钙的含量,进行如下实验:
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟。
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸。
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤。
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置。
步骤5:溶【解析】
将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解。
步骤6:滴定:用0.1000 mol·L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL。反应的化学方程式为:2 KMnO4+5 H2C2O4+3H2SO4= K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式: ;
(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol·L-1,pH≥ ;
(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程)。
查看答案和解析>>
科目: 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(16分)活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用。但随着锌资源的不断开发和利用,锌矿资源越来越少,因此研究利用锌二次资源对缓解锌资源枯竭进程具有重要意义。下图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和FeO)制备活性氧化锌的工艺流程:
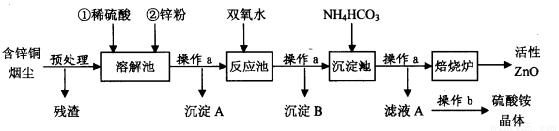
含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3。
(1)操作a名称是____ ,在实验室中,该过程用到的主要玻璃仪器有 。
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:
①将Fe3+还原为Fe2+;② :③调节溶液的pH(控制其在5,0-5.4之间)。
(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是 ;
(4)右表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为
1.0 mol-l计算)。反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方
程式: 。
| 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
2n2+ | 5.9 | 8.9 |
(5)操作b的名称是________ ;
(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3·bZn(OH)2·cH2O(a、b、c均为整数)。某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,则该沉淀的组成为 。
查看答案和解析>>
科目: 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是____ 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
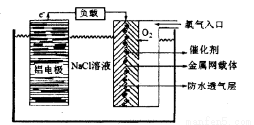
①该电池的总反应化学方程式为____ ;
②电池中NaCI的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCI溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
查看答案和解析>>
科目: 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)(I)三氧化二铁和氧化亚铜(Cu2O)都是红色粉末.常用作颜料。已知氧化亚铜溶于稀硫酸生成Cu和CuSO4。某校化学实验小组为了探究由Fe2O3和Cu2O组成的混合物中两者物质的量相对大小,某同学认为只要取少量粉末放入足量稀硫酸中,通过观察现象即可。
(1)上述实验过程中发生的反应有(用离子方程式表示):
①Fe2O3+6H+= 2Fe3++3H2O
② ③
(2)若实验中观察到溶液变为蓝色且有固体剩余,则n(Cu2O) n(Fe2O3)。(填“>”、“<”或“=”)。
(II)分别在密闭容器的两个反应室中进行如下反应:
左反应室:A(g)+2B(g)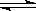 2C(g)
2C(g)
右反应室:2Z(g)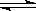 X(g)+Y(g)
X(g)+Y(g)
在反应室之间有无摩擦、可自由滑动的密封板隔断。反应开始和达到平衡时有关物理量的变化如下图所示:

(1)A(g)+2B(g) 2C(g) 的△H 0(填“>”、“<”或“=”)。
2C(g) 的△H 0(填“>”、“<”或“=”)。
(2)在平衡(I)和平衡(Ⅱ)中,X的体积分数 (填序号)。
a.一定相等 b.一定不相等 c.可能相等
(3)达到平衡(I)时,A的转化率为 。
查看答案和解析>>
科目: 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:选择题
化学与社会、生产、生活密切相关。下列说法正确的是
A.加快化石燃料的开采和使用
B.NaHCO3可用于治疗胃酸过多
C.明矾可用于水的杀菌消毒
D.从海水中提取物质都必须通过化学反应才能实现
查看答案和解析>>
科目: 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:选择题
通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是
A.硝酸钠 氢氧化钠 B.氧化铜 二氧化锰
C.氯化钾 碳酸钙 D.硫酸铜 氢氧化钠
查看答案和解析>>
科目: 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B.22.4L SO2含有NA个SO2分子
C.1.6g CH4所含的电子数为NA
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
查看答案和解析>>
科目: 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:选择题
能证明SO2具有漂白性的是
A.品红溶液中通入SO2气体,溶液红色消失
B.溴水中通入SO2气体后,溶液褪色
C.滴入酚酞的NaOH溶液中通入SO2气体,红色消失
D.酸性KMnO4溶液中通入SO2气体后,溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com