
科目: 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:选择题
在恒容密闭容器中进行的反应:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) △H 。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见右图中曲线①②③),测得CO2的平衡转化率与温度关系如下图所示,
C2H5OH(g)+3H2O(g) △H 。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见右图中曲线①②③),测得CO2的平衡转化率与温度关系如下图所示,
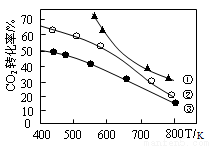
下列有关说法正确的是
A.该反应:△H >0
B.氢碳比:①<②<③
C.其它条件不变的情况下,缩小容器的体积可提高CO2的转化率
D.若起始CO2浓度为2mol·L-1、H2为4mol·L-1,在图中曲线③氢碳比条件下进行,则400K时该反应的平衡常数数值约为1.7
查看答案和解析>>
科目: 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的主要实验流程如下。
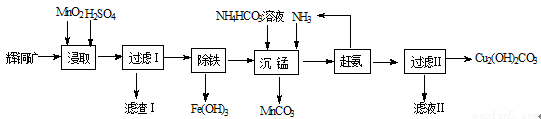
(1)滤渣Ⅰ的成分为MnO2、单质S和 (写化学式);硫酸浸取时,Cu2S被MnO2氧化的化学方程式为 。
(2)浸取时,Fe2O3溶于硫酸的离子方程式为 ;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是 。
(3)“赶氨”时,最适宜的操作方法是 。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
查看答案和解析>>
科目: 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
(15分)长托宁是一种选择性抗胆碱药,可通过以下方法合成(部分反应条件略去):
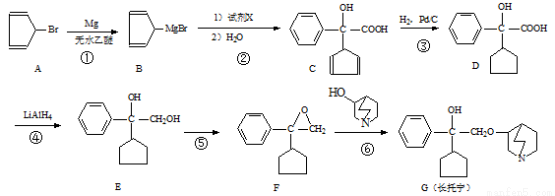
(1)长托宁中的含氧官能团为_________和_________(填名称)
(2)反应②中加入试剂X的分子式为C8H6O3 ,X的结构简式为_________
(3)反应③的反应类型为_______________
(4)S的同分异构体满足下列条件:
①.能与FeCl3溶液发生显色反应。
②.核磁共振氢谱有5个峰且峰的面积比为2:4:4:1:1;分子中含有两个苯环。写出该同分异构体的结构简式_________________
(5)根据已有知识并结合相关信息,写出以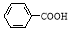 和
和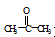 为原料制备
为原料制备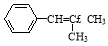 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
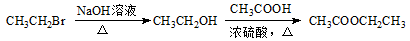
查看答案和解析>>
科目: 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)Co2(OH)2CO3和Co(CH3COO)2·nH2O均是生产高比能锂电池正极材料的前驱体。
(1)这两种钴的化合物中钴的化合价为 。
(2)Co2(OH)2CO3在空气中充分加热生成四氧化三钴,该反应的化学方程式为 。
(3)为确定Co(CH3COO)2·nH2O中的n值及其热分解过程,取一定量的样品在氮气氛围中加热,样品的固体残留率( )随温度的变化如下图所示(样品在300℃前失去结晶水,图中A、B、C、D各处固体均为纯净物,其中C、D为氧化物)。
)随温度的变化如下图所示(样品在300℃前失去结晶水,图中A、B、C、D各处固体均为纯净物,其中C、D为氧化物)。
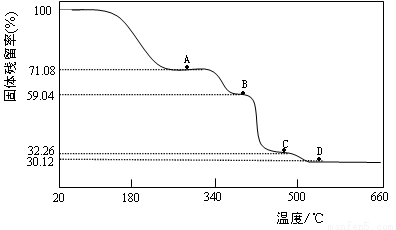
①Co(CH3COO)2·nH2O晶体中n= (填自然数)。
②A→B点反应释放的气体为纯净物(由两种元素组成),该气体的结构简式为 。
③B→C点反应释放CO、CO2两种气体,n(CO)∶n(CO2)= 。
④D点残留固体的化学式为 。(列出上述计算过程)
查看答案和解析>>
科目: 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
(15分)某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:

(1)溶解硼砂时需要的玻璃仪器有:烧杯和 。
(2)用pH试纸测定溶液pH的操作方法为 。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为 。
(4)实验流程中缺少的步骤a、步骤b操作分别为 、 。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:
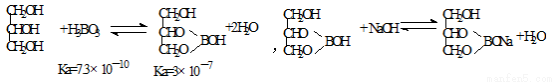
滴定步骤为:

①定到终点时溶液颜色变化是 。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为 (假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果 (选填:“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目: 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:①SO2 (g) +Cl2 (g)+ SCl2 (g) 2SOCl2 (g) △H=a kJ·mol-1
2SOCl2 (g) △H=a kJ·mol-1
②SO2Cl2(g)+ SCl2 (g)  2SOCl2(g) △H=b kJ·mol-1
2SOCl2(g) △H=b kJ·mol-1
则反应:SO2(g) + Cl2 (g)
(g) SO2Cl2(g) △H = kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = 。
SO2Cl2(g) △H = kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = 。
(2)磺酰氯可与白磷发生反应为:P4 + 10 SO2Cl2 = 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为 mol。
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。

①若用浓盐酸与二氧化锰为原料制取Cl2,其 反应的化学方程式为 。
反应的化学方程式为 。
②有关图-1所示的装置说法正确的是 (不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U 形管中盛放的可能是碱石灰
形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为 。
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如图-2所示,已知电池反应为:2Li + SO2Cl2 = 2LiCl + SO2↑;则电池工作时,正极的电极反应式为 。
查看答案和解析>>
科目: 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
[物质结构与性质]磷化硼是一种高折射率红棕色晶体,可通过单质B与Zn3P2(或PH3)反应,也可热解PCl3·BCl3制得。
(1)锌离子基态时核外电子排布式为 。
(2)PH3中磷原子的杂化轨道类型为 , BCl3空间形状为 (用文字描述)。
BCl3空间形状为 (用文字描述)。
(3)PCl3能够与配合物Ni(CO)4 发生配体置换反应:Ni(CO)4 +4PCl3 = Ni(PCl3)4 +4CO。
①与CO互为等电子体且带1个单位负电荷的阴离子化学式为 。
②1molNi(PCl3)4中含 键数目为 。
键数目为 。
(4)立方BP的晶胞结构如图所示,晶胞中含B原子数目为 。
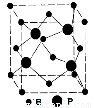
查看答案和解析>>
科目: 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
[实验化学]铝镁加(Almagate)是一种制酸药,其组成为Al2Mg6(O H)14(CO3)2·4H2O,实验室可通过下列实验制备铝镁加。
H)14(CO3)2·4H2O,实验室可通过下列实验制备铝镁加。
步骤1.称取63.5gMgSO4·7H2O(0.26mol),30.5gAl2(SO4)3·18H2O(0.046mol) 溶于400mL水中得到混合溶液A,另称取无水Na2CO352g溶于400mL水得到溶液B。
步骤2.将A、B两溶液同时等速滴加到盛有400mL90℃水的2L三颈烧瓶中,维持90℃,不断搅拌。
步骤3.抽滤,并用蒸馏水洗涤沉淀3~4次,100℃下干燥5h,得白色疏松固体24.3g。
(1)步骤2需缓慢滴加两种溶液并不断搅拌,其主要原因是 。
(2)①步骤3抽滤时用到的硅酸盐质仪器有 、 。
②如何证明沉淀已洗涤干净 。
(3)本次实验所得产品产率为 。
(4)铝镁加中和胃酸的离子方程式为 。
查看答案和解析>>
科目: 来源:2015届江苏连云港市高三上第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.可用丁达尔现象区分溶液与胶体
B.生石灰与水混合的过程只发生物理变化
C.O3是由3个氧原子构成的化合物
D.CuSO4·5H2O是一种混合物
查看答案和解析>>
科目: 来源:2015届江苏连云港市高三上第一次月考化学试卷(解析版) 题型:选择题
物质分类是化学研究的重要方法之一。化学工作者经常根据物质的组成对物质进行分类研究。近年来发现,在金星大气层中存在三氧化二碳。下列物质与它属于同类的是
A.H2、O3 B.H2SO4、H2CO3 C.SO2、NO D.Na2SO3、KClO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com