
科目: 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
已知酸性: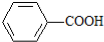 >H2CO3>
>H2CO3>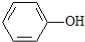
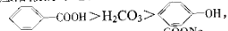 综合考虑反应物的转化率和原料成本等因素,将
综合考虑反应物的转化率和原料成本等因素,将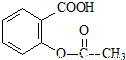 转变为
转变为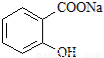 的最佳方法是
的最佳方法是
A.与稀H2SO4共热后,加入足量NaOH溶液
B.与稀H2SO4共热后,加入足量NaHCO3溶液
C.与足量的NaOH溶液共热后,再加入适量H2SO4
D.与足量的NaOH溶液共热后,再通入足量CO2
查看答案和解析>>
科目: 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
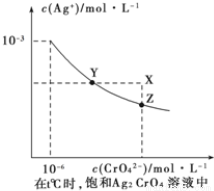
A.在t℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
查看答案和解析>>
科目: 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:

根据上述实验,以下说法正确的是
A.溶液甲中一定含有K2SO3、NaNO2
B.无法判断溶液中是否有K2SO3
C.气体A和气体B-定为混合物
D.原混合物中一定有Fe2O3
查看答案和解析>>
科目: 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:填空题
(9分)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下列空白:
(1)铝元素在周期表中的位置为________。
(2)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金相当。1827 年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)  2Al2O3(s)+3Tic(s) △H=-1176kJ/mol。则反应过程中,每转移1 mol电子放出的热量为________。
2Al2O3(s)+3Tic(s) △H=-1176kJ/mol。则反应过程中,每转移1 mol电子放出的热量为________。
(4)硅与铝同周期,地壳里硅铝的含量:硅________铝(填>,<或=)。是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
(5)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO 3Ba↑+BaO·Al2O3。利用化学平衡移动原理解释上述方法可制取金属Ba的原因是_____________________________________________________________________________。
3Ba↑+BaO·Al2O3。利用化学平衡移动原理解释上述方法可制取金属Ba的原因是_____________________________________________________________________________。
查看答案和解析>>
科目: 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:填空题
(12分)某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要
水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
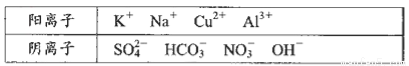
为了鉴别上述化台物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸锁溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化擎式:B________,D________。
(2)将含I mol A的溶液与含l molE的溶液反应后蒸于,仅得到一种化台物,该化合物的化学式为______。
(3)在A溶液中加入少量澄清石灰水,其离子方程式为________________。
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理_____________。
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为______________g。
查看答案和解析>>
科目: 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:实验题
(13分)某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
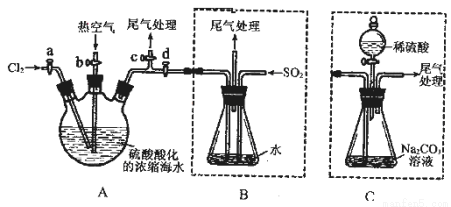
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)实验室中常用来制备氯气的化学方程式为__________________________;
(2)步骤②中鼓入热空气的作用为_____________________________;
(3)步骤③中发生的主要反应的离子方程式为______________________________。
(4)此实验中尾气可用______(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
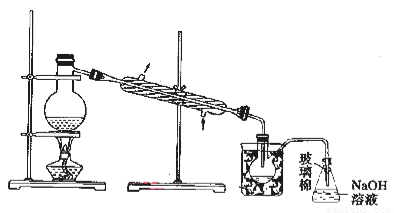
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(7)与B装置相比,采用C装置的优点为____________。
查看答案和解析>>
科目: 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:填空题
(18分)次氯酸钠(NaClO)和亚氯酸钠(NaClO3)都是重要的含氯消毒剂。
(1)NaClO2中,氯元素的化合价为________。
(2)某同学在实验室探究并制作一种家用环保型消毒液(NaClO)发生器,设计了如图的装置,用石墨作电极电解饱和氯化钠溶液。
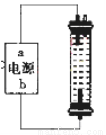
①通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源有b电极名称为_________(填“正”、“负”、“阴”或“阳”)投。
②装置中发生反应的有关化学方程式为________;充分电解后溶液中各离子浓度由大到小顺序为____。
③请说出使用该装置生产消毒液的一个优点和一个注意事项___________________。
(3)化学课外活动小组为测定某品牌“84消毒液”中NaClO的含量(单位体积溶液含有 NaCIO的质量),做了如下实验。已知:ClO-+2I-+2H+=Cl-+I2+H2O I2+2S2O32-=2I-+S4O62-
取10 mL该消毒液于锥形瓶中,迅速加入适量的硫酸酸化的碘化钾溶液,密封、充分混合,暗处放置几分钟。然后加入几滴淀粉溶液,用c mol/L的硫代硫酸钠(Na2S2O3) 标准溶液滴定,平均用去VmL硫代硫酸钠溶液。则该“84消毒液”中NaCIO的含量为_________g/mL(用含c、V的式子表示)。
(4)以下是过氧化氢法生产亚氯酸钠的工艺流程图:
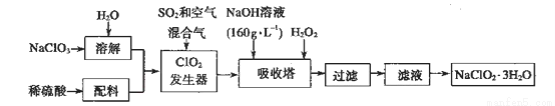
己知:(i)NaClO2 的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
(ii)纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(iii) HClO2可看成是强酸。
①发生器中发生反应的离子方程式为__________,在发生器中鼓入空气的作用可能是_____。
②吸收塔内的反应的化学方程式为__________________。在吸收塔中为防止被还原成NaCI,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂_________(填序号)。
A.Na2O2 B.Na2S C.FeCl2
③从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是_________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
查看答案和解析>>
科目: 来源:2015届河南省名校高三上学期期中考试理综化学试卷(解析版) 题型:选择题
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用,下列做法不正确的是
A.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.铁强化酱油可通过膳食补充人体所需的铁元素
D.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油成分与从石油中提取的柴油成分不同
查看答案和解析>>
科目: 来源:2015届河南省名校高三上学期期中考试理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数。下列说法中,正确的是
A.2.0g重水(2H2O)中含有的质子数为1.0 NA
B.0.1mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA
D.标准状况下,2.24L苯中含有的C-H键的数目为0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com