
科目: 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述I | 叙述II |
A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
B | Fe3+ 具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | 溶解度:CaCO3 < Ca(HCO3)2 | 溶解度:Na2CO3 < NaHCO3 |
D | SiO2 可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目: 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
X、Y、Z、W有如图所示的转化关系,则X、W可能是
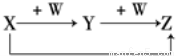
①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2
A.①②③ B.①② C.③④ D.①②③④
查看答案和解析>>
科目: 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
某氯化镁溶液的密度为1.18 g.cm-3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl-离子的物质的量约等于
A.0.37 mol B.1.5 mol C.0.74 mol D.0.63 mol
查看答案和解析>>
科目: 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列物质转化在给定条件下能实现的是
①
②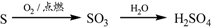
③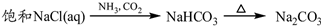
④
⑤
A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
查看答案和解析>>
科目: 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH 溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
查看答案和解析>>
科目: 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:填空题
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可 得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:A: B : C: D : ;
(2)写出A、B、E三种微粒反应的离子方程式: 、 。
查看答案和解析>>
科目: 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:填空题
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700 g样品,配制成100.00 mL溶液A。②准确量25.00mL 溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 0mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-6mol·L-1,应保持溶液中c(Ba2+)≥_______mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4-被还原为MnO2,其离子方程式为 。
(3)通过上述实验事实,该样品的组成为(写化学式) 。
(4)上述实验③KMnO4溶液滴定至终点的现象是)_____________,怎样判断滴定达到了终点 。
查看答案和解析>>
科目: 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:实验题
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2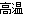 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
查看答案和解析>>
科目: 来源:2015届湖南省益阳市高三上学期第二次模拟考试化学试卷(解析版) 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液D产生沉淀F的离子方程式为______________________________。
(5)滤液E、K中溶质的主要成分是____(填化学式),写出该溶质的一种用途_______。
查看答案和解析>>
科目: 来源:2015届湖南省衡阳市五校高三11月联考化学试卷(解析版) 题型:选择题
有关化学用语的表示正确的是
A.甲烷分子的比例模型是
B.二氧化碳的电子式:
C.Cl—的结构示意图为:
D.HClO的结构式为H—O—Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com