
科目: 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:选择题
已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3·L-3,MgF2的Ksp为7.4×10-11mol3·L-3。下列说法中正确的是( )
A.25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小
B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力
D.25℃时,饱和Mg(OH)2溶液与0.1mol·L-1NaF溶液等体积混合,能生成MgF2沉淀
查看答案和解析>>
科目: 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.有人利用ZrO2作为固体电解质(允许O2-通过)制造出了常温下的甲醇一空气燃料电池。当原电池中有0.5 mol甲醇消耗时,则负极消耗O2—的物质的量为1.5mol
B.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为 g/ml,质量分数为ω,物质浓度为c mol/L,则ρ=(17V+22400)/(22.4+22.4V)g/ml
g/ml,质量分数为ω,物质浓度为c mol/L,则ρ=(17V+22400)/(22.4+22.4V)g/ml
C.已知常温下,氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中C(OH-)=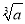 mol/L
mol/L
D.将11.2g的Mg和Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。 再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是0.2mol NO2和0.1mol N2O4
查看答案和解析>>
科目: 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:填空题
(14分)黄铜矿CuFeS2可用于冶炼铜,冶炼原理为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2。
(1)黄铜矿冶炼铜产生的炉渣中主要含Fe2O3、FeSiO3、SiO2、Al2O3等,请完成以下验证炉渣中含有+2价的铁的探究过程中的有关问题:
仅限选择的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水
①应选用试剂为 。
②有关的实验现象为 。
(2)据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O。利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):

①操作a的名称是 ,操作b的操作方法是 。
②检验溶液B中Fe3+是否被除尽的试剂是 ,证明Fe3+已被除尽的现象是 。
③在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案的化学方程式:
方案一: ; 方案二: 。
查看答案和解析>>
科目: 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:填空题
(14分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______ ;ΔH___0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率______ (选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为______ 。
A(g)+B(g)的平衡常数的值为______ 。
查看答案和解析>>
科目: 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:实验题
(14分)芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:
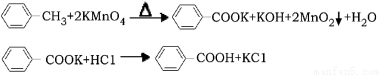
反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:
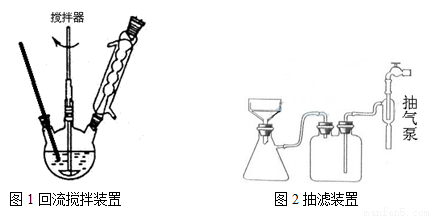
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
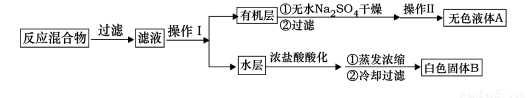
(1)无色液体A的结构简式为 。操作Ⅱ为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
查看答案和解析>>
科目: 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:填空题
(16分)有机物I是制备液晶材料的重要中间体,其合成途径如下:
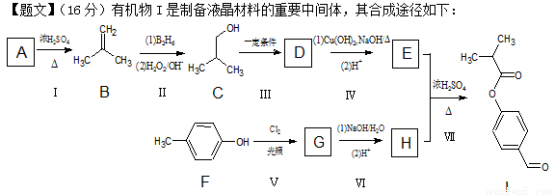
已知:一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的核磁共振氢谱有2种峰,则A的结构简式为 。
(2)C的系统命名法为 。
(3)反应Ⅳ在(1)条件下的离子方程式为 。
(4)反应Ⅰ→Ⅴ中属于氧化反应的有 。
(5)根据反应Ⅱ的信息完成以下反应方程式:
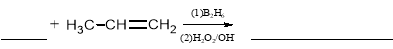 。
。
(6)为反应Ⅲ设计所需试剂与条件是: 。
(7)已知X为E的同分异构体,X与硬酯酸甘油脂具有相同的官能团,还能发生银镜反应。写出所有满足条件的X的结构简式: 。
查看答案和解析>>
科目: 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+的物质的量浓度相等的是
A、200mL0.5mol/LNaCl溶液 B、100mL1mol/LNa2CO3溶液
C、100mL0.5mol/LNa3PO4溶液 D、1L1mol/LNaOH溶液
查看答案和解析>>
科目: 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
X、Y是元素周期表Ⅶ族中的两种元素.下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
查看答案和解析>>
科目: 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
若阿伏加德罗常数的数值用NA表示,下列说法正确的是
A.标准状况下,1.12L氦气所含原子数为0.1NA
B.1.6gNH2— 离子所含质子数为NA
C.22.4 LHCl溶于水,溶液中H+数为NA
D.9g D2O所含的中子数为4.5NA
查看答案和解析>>
科目: 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
下列事实与胶体性质无关的是
A.纳米科技发展有赖于胶体的化学原理与方法
B.三氯化铁中滴入氢氧化钠溶液出现红褐色沉淀
C.一束平行光线照射豆浆时可看到光亮的通路
D.万里长江流入大海处,形成长江三角沙洲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com