
科目: 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为: a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
A.由反应可确定:氧化性HClO3>O2
B.若氯酸分解所得混合气体lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
C.由非金属性Cl>S,可推知酸性HClO3>H2SO4
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
在1100 ℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)  Fe(s)+CO2(g) ΔH=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s)+CO2(g) ΔH=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是
A.若生成1 mol Fe,则吸收的热量小于a kJ
B.若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D.达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L可将气体顺利排出
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(14分)某混合物,可能含有以下几种离子:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:
实验 序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.63 g,第二次称量读数为4.66 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是____________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
阴离子符号 | 物质的量浓度(mol/L) |
(3)试确定K+是否存在?________,如果存在物质的量浓度为__________,如果不存在理由是__ _。
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(16分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
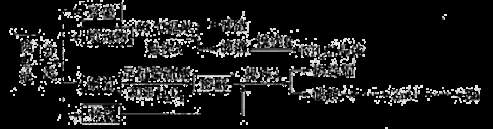
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(10分)蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol/LH2O2溶液,再调节溶液pH至7~8,并分离提纯。
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中加入适量的0.1mol/LH2O2溶液的目的是 ;可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH .
(2)工业上常以Mg2+的转化率为考查指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。
其中,反应温度与Mg2+转化率的关系如图所示。
①步骤III中制备氢氧化镁反应的离子方程式为 。根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是 (填“吸热”或“放热”反应)

②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是 。
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(12分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理,常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
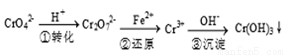
其中第①步存在下列平衡:2CrO42- (黄色) +2H+  Cr2O72-(橙色) +H2O
Cr2O72-(橙色) +H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同
B.2V(Cr2O72-)=V(CrO42-)
C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3=c (Cr3+)?c3(OH-)=10-32
Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3=c (Cr3+)?c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因(用电极反应式解释) ,溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(10分)最近雾霾天气肆虐我国大部分地区,其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是 。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7,H2CO3的电离常数为K1=4.30×10-7,K2=15.60×10-11,则下列微粒可以大量共存的是 (填序号)
A.CO32- 、HSO3- B.HSO3- 、HCO3- C.SO32- 、HCO3- D.HCO3-、H2SO3
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显 性,试解释原因
②在NaHSO3溶液中离子浓度关系不正确的是
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(H2SO3)+c(H+)= c(SO32-)+c(OH-)
C.c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-)
D.c(H+)+ c(Na+)=2c(SO32-)+c(HSO3-)+ c(OH-)
查看答案和解析>>
科目: 来源:2014-2015学年陕西省高三上学期期中理综化学试卷(A)(解析版) 题型:选择题
化学与社会、生产、生活密切相关,下列说法正确的是
A.乙醇和汽油都是可再生能源,应大力推广使用乙醇汽油
B.二氧化氯具有还原性,可用于自来水的杀菌消毒
C.神舟飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅
D.“辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料
查看答案和解析>>
科目: 来源:2014-2015学年陕西省高三上学期期中理综化学试卷(A)(解析版) 题型:选择题
下列离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、S2ˉ、Clˉ、Na+ | NaOH溶液 | Fe3++3OHˉ=Fe(OH)3↓ |
B | Na+、Al3+、Clˉ、SO42ˉ | 少量KOH溶液 | Al3++3OHˉ=Al(OH)3↓ |
C | H+、Fe2+、SO42ˉ、NO3ˉ | BaCl 2溶液 | SO42ˉ+Ba2+=BaSO4↓ |
D | Na+、K+、ClOˉ、SO42ˉ | 通入少量SO2 | 2ClOˉ+SO2+H2O=2HClO+SO32ˉ |
查看答案和解析>>
科目: 来源:2014-2015学年陕西省高三上学期期中理综化学试卷(A)(解析版) 题型:选择题
工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S  2Al2O3+9SO2↑,下列有关说法中正确的是
2Al2O3+9SO2↑,下列有关说法中正确的是
A.反应中Al2(SO4)3被氧化
B.Al2O3是氧化产物
C.该反应中,每转移0.3 mol电子生成5.04 L SO2
D.氧化产物与还原产物的质量之比为1︰2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com