
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。X的最高价氧化物和气态氢化物的分子都是由极性键形成的非极性分子。下列性质比较中正确的是

A.最高价氧化物的水化物的酸性:Y<X<W
B.离子半径由小到大的顺序:W<Z<Y
C.单质晶体的熔点由低到高的顺序:Y<W<Z
D.原子最外层的电子数:Z<Y<X
查看答案和解析>>
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述不相符的是
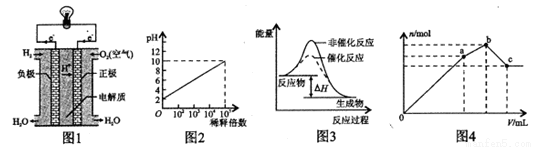
A.图1表示氢氧燃料电池构造示意图
B.图2表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系
C.图3表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4表示向NH4 Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,生成沉淀总物质的量(n)随着Ba(OH)2溶液体积(y)的变化
查看答案和解析>>
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下:
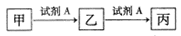
下列说法不正确的是
A.若乙为NaHCO3,则丙一定是CO2
B.若A为氯水,X为金属元素,则甲与丙反应可生成乙
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若甲为单质硫,则丙溶于水形成的浓溶液能与碳反应可生成乙
查看答案和解析>>
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
A.当x=0.2,则混合溶液中y可能大于7或小于7
B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-)
C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-)
查看答案和解析>>
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
工业上正在研究利用CO2来生产甲醇燃料,该方法的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H=-49.0kJ/mol,一定温度下,在三个容积均为3.0L的恒容密闭容器中发生该反应:
CH3OH(g)+H2O(g) ?H=-49.0kJ/mol,一定温度下,在三个容积均为3.0L的恒容密闭容器中发生该反应:
容器 | 起始物质的量/mol | 平衡物质的量/mol | |||
编号 | 温度/℃ | CO2(g) | H2(g) | CH3OH(g) | H2O(g) |
Ⅰ | T1 | 3 | 4 | 0.5 | 0.5 |
Ⅱ | T1 | 1.5 | 2 | ||
Ⅲ | T2 | 3 | 4 | 0.8 | 0.8 |
下列有关说法不正确的是
A.若经过2min容器I中反应达平衡,则2min内平均速率V(H2)=0.25 mol/(L·min)
B.达到平衡时,容器I中CO2转化率的比容器Ⅱ的大
C.达到平衡时,容器Ⅲ中反应放出的热量比容器Ⅱ的2倍少
D.若容器Ⅰ、Ⅱ、Ⅲ中对应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3
查看答案和解析>>
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
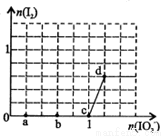
A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
查看答案和解析>>
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
向一定量的Cu、Fe2O3的混合物中加人600mL 2mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,再加入过量1 mol/L NaOH溶液,将沉淀过滤、洗涤、干燥,称得质量比原混合物增重17.6g,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量是
A.4.8 g B.8.8 g C.9.6g D.14.4g
查看答案和解析>>
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:填空题
(16分)X、Y、Z、E、M、Q、R为七种短周期的主族元素,它们的原子序数依次增大,其中X+无电子,Y、Z同一周期且相邻,X与E、Z与Q分别为同一主族,M的原子序数是Y的2倍,Q的质子数比E多5。J为ds区原子序数最小的元素。请用推断出的元素回答下列问题:
(1)Y、Z、Q三元素的第一电离能由大到小的顺序为__________,Y2 、X2分子中共价键的数目之比为_________,MR4分子的中心原子的杂化轨道类型是_______。
(2)由Q、R两元素可按原子个数比l:l组成化合物T,化合物T中各原子均满足8电子的稳定结构,则T的电子式为________。固体化合物E2Z2投人到化合物E2Q的水溶液中,只观察到有沉淀产生,该反应的离子方程式为______________________。
(3)J元素基态原子的外围电子排布式为___________。向JQZ4溶液中逐滴加人Y元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解得到深蓝色的透明溶液,该沉淀溶解的离子方程式是_____________。
(4)J2Z为半导体材料,在其立方晶胞内部有4个Z原子,其余Z原子位于面心和顶点,则该晶胞中有______个J原子。
查看答案和解析>>
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:填空题
(10分)甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,A和B都极易溶于水,用玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白烟。各物质之间存在如下图所示的转化关系:

请回答下列问题:
(1)丙与A反应生成乙和C的化学反应方程式为——————
(2)向0.1 mol/L的C溶液中通入A至显中性,溶液中各离子浓度由大到小的顺序为:__________.
(3)常温下取M的饱和溶液与AgI的饱和溶液等体积混合,再加入足量的AgNO3浓溶液发生反应,则生成沉淀的物质的量较多的是________。(填化学式)
(4)电解尿素[CO(NH2)2]的碱性溶液制取甲的装置示意图如右图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。

电解时,b极的电极反应是_______。若在a极产生112mL气体(标准状况),则消耗尿素的质量为______g。
查看答案和解析>>
科目: 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:填空题
(8分)二甲醚是一种重要的清洁燃料,有多种合成方法。
方法一:通过CH~OH分子间脱水制得:2CH3OH(g)=CH3OCH3(g)+H2O(g) ?H=-23.5 kJ/mol ①
(1)该反应在恒容密闭的容器中进行,能说明反应达到平衡的是_____。(填字母编号)
A.容器中压强不再变化
B.n(CH3OH):nCH3OCH3):n(H2O)=2:1:1
C.c(CH3OH)=c(CH3OCH3)=c(H2O)
D.混合气体中各组分浓度不再变化
E.混合气体的平均相对分子质量不再变化
(2)在T℃时该反应的平衡常数K=5,若在此温度下某时刻测定出该反应中各物质的浓度为c(CH3OH)=0.3 mol/L、c(CH3OCH3)=0.6 mol/L、c(H2O)=0.6mol/L,则此时正、逆反应速率的大小是V(正)____V(逆)。(填“>”、“<”或“=”
(3)3H2(g)+3CO(g)= CH3OCH3+3CO2(g) ?H=-a kJ/mol ②
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是_________。(填字母编号)

A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚
(4)该反应可以分步进行:
4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H3 ③
CO(g)+H2O(l)=CO2(g)+H2(g) △H4=-bKJ/mol ④
H2O(l)=H2O(g) △H5=+44KJ/mol ⑤
则反应③的焓变△H3=________KJ/mol(用含a、b的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com