
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
关于25℃时,pH = 12的NaOH溶液,下列说法错误的是
A.c(OH-) =c(Na+) + c(H+)
B.由水电离出的c(OH-) = 1.0×10-12 mol·L-1
C.与等体积pH = 2的醋酸混合后所得溶液显碱性
D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中: c(Na+)> c(NH4+)
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
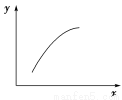
选项 | x | y |
A | MgSO4的质量(忽略体积) | CO的转化率 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | 温度 | 容器内混合气体的密度 |
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于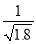 ×10-11 mol·L-1
×10-11 mol·L-1
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质FeS、MnS,使这些金属离子形成硫化物沉淀除去。根据以上事实,可推知FeS、MnS具有的相关性质是
A.在水中的溶解能力大于 CuS、CdS、PbS
B.在水中的溶解能力小于CuS、CdS、PbS
C.在水中的溶解能力与CuS、CdS、PbS相同
D.二者均具有较强的吸附性
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中,一定能大量共存的是
①无色溶液中:K+、Na+、HCO3-、Al3+
②pH=11的溶液中:Na+、Ba2+、AlO2-、OH-
③水电离出的c(H+) =10-12mol·L-1的溶液中:Mg2+、NH4+、HCO3-、S2-
④加入Al放出H2的溶液中:Cu2+、NH4+、Cl-、NO3-
⑤无色溶液中:K+、Na+、CO32-、SO42-
⑥酸性溶液中:Ca2+、NO3-、Cl-、I-
A.①④ B.④⑥ C.②⑤ D.②③
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是
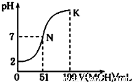
A.HA为一元强酸,MOH为一元强碱
B.N点水的电离程度小于K点水的电离程度
C.K点所示溶液中c(A-)>c(M+)
D.K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同
B.室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中 减小
减小
C.醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液后溶液呈中性则c(NH4+)=c(Cl-)
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)(1)要除去MgCl2酸性溶液里少量的Fe3+,可选用的试剂是 (填序号) 。
A.MgO
B.MgCO3
C.NaOH
D.Mg(OH)2
E.Fe(OH)3
(2)某温度下纯水中C(H+)=2×10-7 mol/L,则此时溶液中的C(OH-) = ;若温度不变,滴入稀盐酸使C(H+)=5×10-6 mol/L,则此时溶液中的C(OH-) = 。
(3)某温度下纯水的c(H+)=1.0×10-6 mol?L-1,在此温度下,将pH=8的Ba(OH)2与pH=5的稀盐酸混合,欲使pH=7,则Ba(OH) 2与稀盐酸的体积比为 。
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(16分)
化学式 | NH3·H2O | HCN | CH3COOH | H2CO3 |
电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
(1)电离平衡常数是衡量弱电解质电离程度强弱的量。上表中给出几种弱电解质的电离平衡常数,从中可以判断:在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为 。
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,三种溶液的pH由大到小的顺序为 。(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-) c(K+)-c(CH3COO-)。(填“>”、“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈 性(填“酸”、“碱”或“中”),用离子方程式表示原因 。
④室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是 。
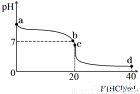
⑤NH4HCO3溶液呈 性(填“酸”、“碱”或 “中”)。
(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式 。
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO-3)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26 CO32--52e-===34CO2+10H2O。
试回答下列问题:
(1)该燃料电池中发生氧化反应的物质是 。
(2)该燃料电池的化学反应方程式为 ;
(3)某学生想用该燃料电池电解饱和食盐水,写出反应的离子方程式 。
(4)当电路中通过0.26NA的电子时,消耗的氧气的体积(标况)为 ;此时电解饱和食盐水生成的氯气的物质的量是 ;若此时溶液体积为200ml,则生成的NaOH的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com