
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
25℃时,5 mL O.1 mol /l的 H2S04和15 ml O.1 mol/lNa0H溶液相混合并稀释至500 ml,所得溶液的pH为
A.12.3 B.11 C.3 D.1.7
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
在T℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是
A.由水电离的c(H+):①=②>③=④
B.将①、④两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.①②的导电性不同,③④的导电性也不同
D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>①
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下图曲线a和b是盐酸与氢氧化钠溶液相互滴定的曲线,下列叙述正确的是
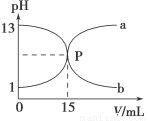
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3- )>c(CO32 -)>c(H2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)= c(HCO3- )+2c(H2CO3)
C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO32 -)>c(HCO3- )>c(OH-)>c(H+)
D.CH3COONa和CH3COOH混合溶液一定存在:c(Na+)= c(CH3COO-)=c(CH3COOH)>c(H+)= c(OH-)
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.25 ℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH
B.饱和小苏打溶液中:c(Na+)=c(HCO3-)
C.Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小
D.室温下,对于0.10 mol·L-1的氨水,用HNO3溶液完全中和后,溶液不显中性
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,下列判断一定正确的是
A.若c(OH-)>c(H+),a=b B.若c(K+)>c(CH3COO-),a>b
C.若c(OH-)=c(H+),a>b D.若c(K+)<c(CH3COO-),a<b
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O 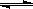 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu +O2↑+4H+
2Cu +O2↑+4H+
C.NaHS电离方程式:NaHS  Na+ + HS-
Na+ + HS-
D.NH4Cl水解反应:NH4+ +2H2O  NH3·H2O + H3O+
NH3·H2O + H3O+
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:填空题
(10分)请回答下列问题:
(1)CH4和H2O在催化剂表面发生反应CH4+H2O(g)? CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
温度/℃ | 800 | 1 000 | 1 200 | 1 400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1 771.5 |
①该反应是________(填“吸热”或“放热”)反应
②T ℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时c(CH4)=0.5 mol·L-1,计算该温度下CH4+H2O(g) CO+3H2的平衡常数K=______,该温度下达到平衡时H2的平均生成速率为_______________
CO+3H2的平衡常数K=______,该温度下达到平衡时H2的平均生成速率为_______________
(2)常温下,取pH=2的盐酸和醋酸各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸pH变化曲线的是________(填“A”或“B”)。设盐酸中加入的Zn粒质量为m1,醋酸中加入的Zn粒质量为m2。则m1________m2(填“<”、“=”或“>”)。
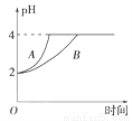
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:填空题
(10分)现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液; ②0.01 mol·L-1 HCl溶液;
③pH=12的氨水; ④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是______(填序号,下同),水的电离程度相同的是______;
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②________③(填“>”、“<”或“=”);
(3)将前四份溶液同等稀释10倍后,溶液的pH:
①________②,③________④ (填“>”、“<”或“=”);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com