
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列关于电解质溶液的正确判断是
A.在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存
C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH===B++OH-
D.由0.1 mol·L-1一元酸HA溶液的pH=3可推知NaA溶液存在A-+H2O HA+OH-
HA+OH-
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
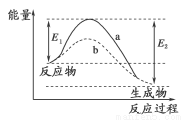
A.a与b相比,b的活化能更高
B.反应物断键吸收的总能量大于生成物成键释放的总能量
C.a与b相比,反应的平衡常数一定不同
D.a与b相比,b的反应速率更快
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
甲烷燃料电池分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列说法正确的是
A.总反应式都为CH4+2O2===CO2+2H2O
B.H2SO4和NaOH的物质的量都不变,但浓度都减小
C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O===CO2+4H+
D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-===4OH-
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
将4 mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生反应:2A(g)+B(g) 2 C(g),经2s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是
2 C(g),经2s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是
A.用物质A表示反应的平均速率为0.3 mol·L-1·s-1
B.用物质B表示反应的平均速率为0.3 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.3 mol·L-1
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
已知某可逆反应:mA(g)+nB(g)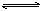 r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
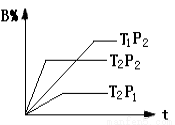
A.T1>T2,p1>p2,m+n>r,正反应吸热
B.T1<T2,p1<p2,m+n<r,正反应吸热
C.T1>T2,p1>p2,m+n<r,正反应放热
D.T1<T2,p1<p2,m+n>r,正反应放热
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-890.3 kJ·mol-1
B.由N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子 时,反应放出的热量小于92.4 kJ
2NH3(g) △H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子 时,反应放出的热量小于92.4 kJ
C.HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101 kPa时,4gH2完全燃烧生成液态水,放出571.6 kJ热量,氢气燃烧热的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
将下图所示实验装置的K闭合,下列判断正确的是

A.Cu电极上发生氧化反应 B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(K+)增大 D.片刻后可观察到滤纸a点变红色
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
把下列溶液加水稀释,溶液中每种离子的浓度都不会增加的是
A.CH3COOH溶液 B.NaCl溶液 C.NaOH溶液 D.FeCl3溶液
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列溶液一定呈中性的是
A.c(H+)=c(OH-)=10-6 mol·L-1的溶液
B.pH=7的溶液
C.使石蕊试液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目: 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者大于后者
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大
D.室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com