
科目: 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
(12分)已知某反应在不同条件下的反应历程可以表示成下图,
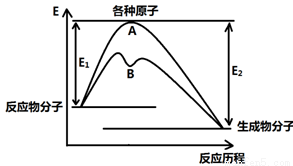
E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
(1)据图判断该反应是 (填“吸”或“放”)热反应,如该反应可逆,则其达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”),其中B历程表明此反应改变的条件为 (填字母)。
A.增大反应物的浓度 B.降低温度 C.增大压强 D.使用催化剂
(2)下表给出了一些化学键的键能:
化学键 | H—H | Cl—Cl | O=O | O—H | H—Cl |
键能(kJ·mol-1) | 436 | 247 | x | 463 | 431 |
①若图中表示反应H2(g) +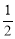 O2(g)=H2O(g) ΔH= - 241.8 kJ·mol-1,则x= kJ·mol-1(保留一位小数)。
O2(g)=H2O(g) ΔH= - 241.8 kJ·mol-1,则x= kJ·mol-1(保留一位小数)。
②催化剂、加热条件下可用氧气与氯化氢气体反应置换出氯气,同时生成另一种气态化合物,利用上表数据写出该热化学方程式 ,当该反应中有1 mol电子发生转移时,图像中历程A的E1= kJ(保留一位小数)。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)(1)已知某反应的平衡常数表达式为:K= ,则它所对应反应的化学方程式是 。
,则它所对应反应的化学方程式是 。
(2)合成甲醇的主要反应是:2H2(g)+CO(g)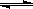 CH3OH(g) △H=-90.8 kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g) △H=-90.8 kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度(mol/L) | 0.2 | 0.1 | 0.4 |
(A)该时间段内反应速率v(H2)=
(B)比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
(C)反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向
(填“逆向”、“正向”或“不”)移动,平衡常数K (填“增大”、“减小” 或“不变”)。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
(12分)
(1)图1装置发生反应的离子方程式为 。
图2装置中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL0.5mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
①电源的M端为 极,甲烧杯中铁电极的电极反应式为 。
②乙烧杯中电解反应的化学方程式为 。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
(3)图3是乙醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出a处的电极反应式 。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:实验题
(12分)用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+8H2O(l) ΔH<0
一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化,所用注射器的容积充裕):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
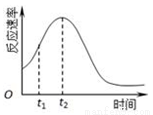
(1)该实验探究的是 因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: < (填实验序号)研究发现反应速率总是如图所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,② 。
(3)若实验①在4 min末收集了4.48 mL CO2(标准状况),则4 min末c(MnO4-)= mol·L-1(假设溶液混合后体积为50 mL),此4 min内的平均速率为v(H2C2O4)= 。
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定 来比较化学反应速率。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
(14分)2013年10月9日,2013年诺贝尔化学奖在瑞典揭晓,犹太裔美国理论化学家马丁·卡普拉斯、美国斯坦福大学生物物理学家迈克尔·莱维特和南加州大学化学家亚利耶·瓦谢尔因给复杂化学体系设计了多尺度模型而分享奖项。三位科学家的研究成果已经应用于废气净化及植物的光合作用的研究中,并可用于优化汽车催化剂、药物和太阳能电池的设计。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式为 。
2CO2(g)+ N2(g) △H<0同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式为 。
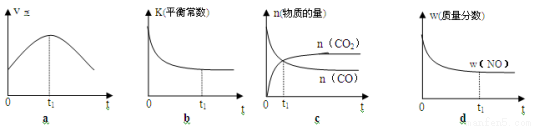
(2)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2,在900℃时发生吸热反应并记录前5min各物质的浓度,第6min改变了条件。各物质的浓度变化如下表;
时间/min | CO2(mol·L-1) | H2(mol·L-1) | CO(mol·L-1) | H2O(mol·L-1) |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率为 ;
②第5—6min,平衡移动的可能原因是 ;
(4)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1
2NO2(g)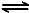 N2O4(g) △H=-56.9 kJ·mol-1
N2O4(g) △H=-56.9 kJ·mol-1
H2O(g) = H2O(l) △H = -44.0 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是 mol
(6)在一定条件下,也可以用H2处理CO合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
下列说法错误的是
A.两位美国科学家和一位德国科学家因研制出超分辨率荧光显微镜而共享了2014年诺贝尔化学奖
B.大雾天气常造成机场封闭、飞机航班延误,气象中的雾属于胶体
C.借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素
D.同位素的应用已遍及各个领域,在医疗上利用同位素的放射性治疗肿瘤
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
世界卫生组织(WHO)将ClO2列为A1级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒方面有广泛的应用。ClO2属于
A.酸 B.碱 C.氯化物 D.氧化物
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.复分解反应一定不是氧化还原反应
B.置换反应一定是氧化还原反应
C.有单质参加的化合反应一定是氧化还原反应
D.没有单质生成的分解反应一定不是氧化还原反应
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.HNO3的摩尔质量为63
B.摩尔是物质的量的单位
C.1 mol任何物质都约含有6.02×1023个原子
D.64 g SO2中含有1mol O2
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
下列原子结构模型与科学家对应不正确的一项是:
A.阿伏加德罗的原子学说
B.汤姆生的“葡萄干面包式”原子结构模型
C.卢瑟福的带核原子结构模型
D.玻尔的核外电子在一定轨道上运动的观点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com