
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A一定是强酸
B.用已知浓度的盐酸滴定未知浓度的氨水,选用最佳指示剂为酚酞
C.若用50ml 0.55mol/L的NaOH溶液,分别与50ml 0.50mol/L的盐酸和50ml 0.50mol/L的硫酸充分反应,两反应的中和热相等
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③
查看答案和解析>>
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应
①Br2 + 2e- = 2Br- ②2Br- - 2e- = Br2 ③Zn – 2e- = Zn2+ ④Zn2+ + 2e- = Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
A.②和③ B.②和① C.③和① D.④和①
查看答案和解析>>
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
①已知BaSO4的Ksp=C(Ba2+)·C(SO42-),所以在硫酸钡溶液中有C(Ba2+)=C(SO42-)=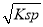 mol/L;
mol/L;
②常温下,强酸溶液的PH=a,将溶液的体积稀释到原来的10n倍,则PH=a+n;
③将0.1mol/L的NaHS和0.1mol/L的Na2S溶液等体积混合,所得溶液中有C(S2-)+2C(OH-)=2C(H+)+C(HS-)+3C(H2S);
④在0.1mol/L氨水中滴加0.1mol/L盐酸,恰好中和时PH=a,则由水电离产生的C(OH-)=10-amol/L
A.①④ B.②③ C.③④ D.①②
查看答案和解析>>
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可作空军通信卫星的电源,其工作原理如下图所示,

下列说法正确的是
A.每消耗3mol H2O2,转移的电子为3mol
B.电池放电时,Na+从a极区移向b极区
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
查看答案和解析>>
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
SO2通过下列工艺流程可以制取化工原料H2SO4和清洁能源H2。下列说法正确的是
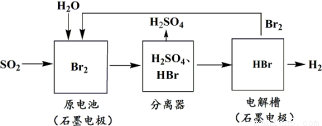
A.电解槽中也可以用铁电极代替石墨作为阳极
B.原电池中负极的电极反应为:SO2+2H2O-4e-=SO42-+4H+
C.该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4
D.该生产工艺的优点是Br2被循环利用,原电池产生的电能可以充分利用,还能获得清洁能源
查看答案和解析>>
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
某温度下,向一定体积0.1mol/L的醋酸溶液中逐滴加入0.1mol/L的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则
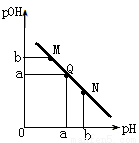
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中C(CH3COO-)>C(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:填空题
(4分)工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? (填“是”或“否”),理由是 。
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有 。(多选)
A.NaOH
B.氨水
C.Cu2(OH)2CO3
D.Na2CO3
E.CuO
F.Cu(OH)2
查看答案和解析>>
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:填空题
(5分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c1 | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸: 。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1? (选填“是”或“否”)。
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
①c(Na+)-c(A-)= mol·L-1;
②c(OH-)-c(HA)= mol·L-1。
查看答案和解析>>
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:填空题
(6分)(1)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用同样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为 。
(2)NO2可用氨水吸收生产硝酸铵,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液中滴加bL氨水后溶液显中性,则滴加氨水的过程中水的电离平衡将会 (填“正向”、“逆向”或“不”) 移动,所滴加氨水的浓度为 mol/L。(已知氨水的电离平衡常数Kb=2×10-5)
查看答案和解析>>
科目: 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为: H2SO4=H++HSO4-,HSO4- H++SO42-。.
H++SO42-。.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)。
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
A.c(SO42-)+c(HSO4-)=0.1 mol·L-1
B.c(SO42-)+c(HSO4-)=2c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>”“=”或“<”),原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com