
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是

A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
下图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是

A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g)  2B(g) +C(g)
2B(g) +C(g)
查看答案和解析>>
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
在恒容密闭容器中发生反应2NO2  2NO+O2,下列所述可以说明反应达到平衡状态的是
2NO+O2,下列所述可以说明反应达到平衡状态的是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变
A.①③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)  2C(g),
2C(g),
2 min后达到平衡,生成0.4 mol C,测得混合气体共3.4 mol,则下列结果正确的是
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x值等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是

A.X和Y不连接时,铜棒上会有金属银析出
B.X和Y用导线连接时,银棒是正极,发生氧化反应
C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
查看答案和解析>>
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
某学生根据反应2HCl+2Ag === 2AgCl+H2↑的原理,设计了下图所示的四个装置,你认为合理的是
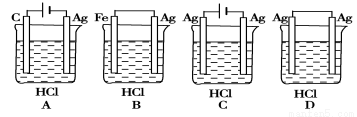
查看答案和解析>>
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:填空题
(12分)I.在温度为T时,向2.0 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应A(g)+B(g)  C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A) =____________
(2)温度为T时,该反应的化学平衡常数=
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH (填 “>0” 或 “<0”)
(4)相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”)
(5)下列措施能增大反应速率,且平衡往正反应方向移动是 。
a.及时分离出A气体
b.适当升高温度
c.增大B的浓度
d.选择高效催化剂
II.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是
查看答案和解析>>
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:填空题
(14分)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
(1)写出铜溶于上述混合溶液的离子方程式 。
(2)若在如图Ⅰ所示的装置中发生(1)中的反应,

则X极是 (“正极”或“负极”),电极反应式是
(3)铜完全溶解时,所得溶液中Fe3+、Cu2+、H+三种阳离子的浓度均为0.2 mol/L(假设溶液体积不变),若用电解方法回收铜,装置如图Ⅱ所示。

①电解开始阶段,阳极的电极反应式为 ,阴极的电极反应式为 。
②判断溶液中的Cu2+已完全析出的现象是 。当Cu2+恰好完全析出时,转移电子的物质的量 。
查看答案和解析>>
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:实验题
(12分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H 2C2O4 + 3H2SO4 === K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
实验编号 | 温度/℃ | 试管中所加试剂及其用量/ mL | 溶液褪至无色所需时间/ min | |||
0.6 mol/L H 2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
1 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 20 | 3.0 | m | 2.5 | n | 4.8 |
3 | 20 | 3.0 | 3.0 | 2.0 | 2.0 | t1 |
4 | 30 | 3.0 | 2.0 | 3.0 | 2.0 | t2 |
(1)已知:实验1、2、3的目的是探究KMnO4浓度对反应速率的影响。则实验2中m= ,
n= 。如果研究温度对化学反应速率的影响,需利用实验4和 。
(2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如图所示。

为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
①请你填写表中空白帮助该小组同学完成实验方案。
实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/ min | |||
0.6 mol/L H 2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||||
5 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | t3 | |
②能说明该小组同学提出的假设成立的实验事实是 。
(3)有人将酸性KMnO4 溶液和H 2C2O4 溶液的反应设计成原电池,则该原电池的正极反应式为 。
查看答案和解析>>
科目: 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:填空题
(14分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为 (保留小数点后一位);T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
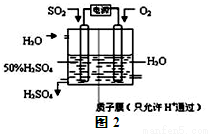
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com