
科目: 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:选择题
向100mL0.1mol·L–1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol·L—1Ba(OH)2溶液。随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示。
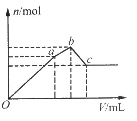
下列叙述正确的是
A.a点的沉淀总物质的量为0.03mol
B.Oa段发生反应的离子方程式是:Al3++2SO42—+2Ba2++3OH–== Al(OH)3↓+2BaSO4↓
C.ab段发生反应的离子方程式是:2NH4++SO42—+Ba2++2OH–== 2NH3·H2O+BaSO4↓
D.反应到c点时,加入Ba(OH)2溶液的总体积为250mL
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:实验题
(12分)化学是一门以实验为基础的学科,试回答以下问题。

(1)选用装置甲、戊制取并收集少量氨气,氨气应从收集装置的 (填“长”或“短”)导管进气,写出利用该装置制备氨气的化学方程式 。
(2)选用装置乙、丙制备少量一氧化氮气体,乙中塑料板上若放置大理石,则装置乙的作用是 ,丙中产生NO的离子方程式为 。
(3)二氧化氯(ClO2)为A1级消毒剂,某研究小组利用丁装置制备ClO2。
①在烧瓶中放入KClO3和草酸(H2C2O4),然后加入足量的稀硫酸,水浴加热。反应生成ClO2、CO2和一种酸式盐,则该反应中氧化产物与还原产物物质的量之比为 。
②温度过高时,二氧化氯的水溶液有可能引起爆炸。在反应开始前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60~80℃之间,丁装置中缺少的一种必需的玻璃仪器名称是 。
③将二氧化氯溶液加入到硫化氢溶液中,加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成,该沉淀的化学式为 。
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:实验题
(14分)Na2S2O3·5H2O俗称“海波”,常用于脱氧剂、定影剂和还原剂,是无色易溶于水的晶体,不溶于乙醇,在20°C和70°C时的溶解度分别为60.0g和212g, Na2S2O3·5H2O于40~45°C熔化,48°C分解。已知Na2S2O3的稀溶液与BaCl2溶液混合无沉淀生成。下面是Na2S2O3·5H2O的实验室制备及相关性质实验。
制备海波的反应原理:Na2SO3+S Na2S2O3
Na2S2O3
制备海波的流程:
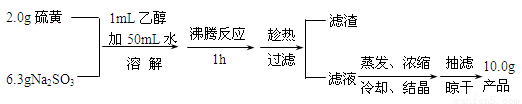
(1)实验开始时用1mL乙醇润湿硫粉的作用是 (填字母)。
A.有利于亚硫酸钠与硫黄的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是 。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 (填字母)。
A.无水乙醇 B.饱和NaCl溶液 C.水 D.滤液
(5)为验证产品中含有Na2SO3和Na2SO4,请将以下实验方案补充完整(所需试剂从稀HNO3、稀H2SO4、稀HCl、BaCl2溶液、蒸馏水中选择)。
①取适量产品配成稀溶液, ,生成白色沉淀;
② ,若沉淀未完全溶解,且有刺激性气味气体产生,则可确定产品中含有Na2SO3和Na2SO4。该流程制得的Na2S2O3·5H2O粗产品可通过 方法提纯。
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:填空题
(10分)以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:

回答下列问题:
(1)写出氧化步骤中发生的主要反应的离子方程式 。
(2)如何检验中和液中的杂质离子已完全除尽? 。
(3)固体NH4Al(SO4)2·12H2O[相对分子质量:453]在加热时,固体残留率随温度的变化如图所示。
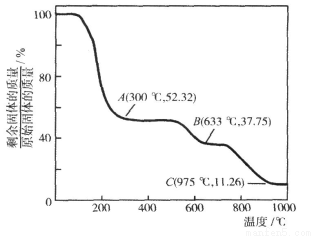
633℃时剩余固体的成分化学式为 。
(4)综上分析,流程图中M的主要成分的化学式为 ,M可用一种物质吸收以实现循环利用,该物质的名称是 。
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:填空题
(14分)氢能以其洁净、高效、高热值、环境友好等特点成为最有前途的新能源,制氢和储氢的方法有很多。
(1)下图所示电化学装置工作时均与H2有关。

①图A所示装置可用于电解K2MnO4制KMnO4,通电一段时间后阴极附近溶液的pH将会 (填“增大”、“减小”或“不变”) 。
②图B所示装置为吸附了氢气的纳米碳管等材料制作的二次电池的原理,
开关连接用电器时,镍电极发生 (填“氧化”或“还原”)反应;开关连接充电器时,阳极的电极反应为 。
(2)热化学循环法制氢。已知:
①2Br2(g)+2CaO(s) == 2CaBr2(s)+O2(g) △H= —146kJ·mol—1
②3FeBr2(s)+4H2O(g) == Fe3O4(s)+6HBr(g)+H2(g) △H= +384kJ·mol—1
③CaBr2(s)+H2O(g) == CaO(s)+2HBr(g) △H= +212kJ·mol—1
④Fe3O4(s)+8HBr(g) == Br2(g)+3FeBr2(s)+4H2O(g) △H= —274kJ·mol—1
则2H2O(g) == 2H2(g)+O2(g)的△H= kJ·mol—1。
(3)光电化学分解制氢,原理如图所示,钛酸锶光电极的电极反应为4OH–– 4e–===O2+2H2O,则铂电极的电极反应为 。

(4)生物质制氢,若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及H2]在1.01×105Pa下进入转换炉,改变温度条件,各成分的体积组成关系如下图所示。下列有关图像的解读正确的是 。

A.利用CH4与H2O(g)及CO2转化为合成气CO和H2理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g)+H2O(g) → CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2的适宜温度约为900℃
D.图像中曲线的交点处表示反应达到平衡
(5)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出该分解反应的化学方程式 。
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:填空题
(20分)三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制备三氯化铬的流程如下图所示:
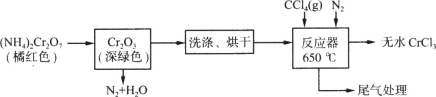
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净? 。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是 。
(3)用下图装置制备CrCl3时,
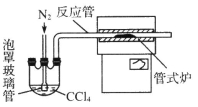
反应管中发生的主要反应为: Cr2O3+3CCl4==2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为:
① ;
② 。
(4)样品中三氯化铬质量分数的测定:称取样品0.3000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1g Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L–1H2SO4至溶液呈强酸性,此时铬以Cr2O72–存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入1mL指示剂,用0.0250mol·L–1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2 == Na2S4O6+2NaI)
①滴定实验可选用的指示剂名称为 ,判定终点的现象是 ;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果 (填“偏高”“偏低”或“无影响”)。
②加入Na2O2后要加热煮沸,其主要原因是 。
③加入KI时发生反应的离子方程式为 。
④样品中无水三氯化铬的质量分数为 。(结果保留一位小数)
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:填空题
(10分)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如下图所示。请回答下列问题:
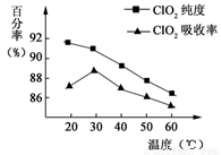
(1)由图可知,反应时需要控制的适宜温度是 ℃。
(2)黄铁矿中的硫元素在酸性条件下被ClO3—氧化成SO42—,写出制备二氧化氯的离子方程式 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得500mLClO2溶液,取出25.00mL,加入42.00mL0.500mol·L—1(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500mol·L—1K2Cr2O7标准溶液滴定至终点,消耗20.00mL。反应原理如下:
4H++ClO2+5Fe2+==Cl—+5Fe3++2H2O
14H++Cr2O72—+6Fe2+ ==2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(请写出计算过程)。
查看答案和解析>>
科目: 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
下列实验方法能达到目的的是
A.用氨水清洗试管内壁附着的银镜
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
D.可用K3[Fe(CN)6]溶液鉴定FeCl3溶液中是否存在Fe2+
查看答案和解析>>
科目: 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
下列反应与Na2O2+SO2==Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+2CO2==2Na2CO3+O2↑ B.2Na2O2+2SO3==2Na2SO4+O2↑
C.Na2O2+H2SO4==Na2SO4+H2O2 D.3Na2O2+Cr2O3==2Na2CrO4+Na2O
查看答案和解析>>
科目: 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中不正确的有
A.标准状况下,20 g重水(D2O)中含有的电子数为10NA
B.乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
C.22.4 L的N2的共用电子对数为3NA
D.78gNa2O2固体中含有的阴离子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com