
科目: 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列图示与对应的叙述不相符的是
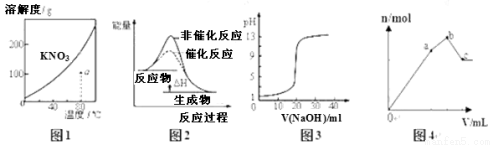
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目: 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | K1=1.77×10-4 | K1=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是
A.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
B.相同温度时,等浓度的HCOONa和NaCN溶液的pH前者小于后者
C.2CN-+H2O+CO2 = 2HCN+CO32-
D.2HCOOH+CO32-= 2HCOO-+H2O+CO2↑
查看答案和解析>>
科目: 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列溶液中有关物质的量浓度关系正确的是
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)
B.pH相等的CH3COONa和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)=c(A-)
D.0.1 mol·L-1的 NaHA 溶液pH=1则有c(Na+)=c(H2A)+c(HA-)+c(A2-)
查看答案和解析>>
科目: 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
FeCl3+H2S=FeCl2+S;PbO2+4HCl=PbCl2+Cl2↑+2H2O
2Fe(OH)2+Cl2+2KOH=2Fe(OH)3+2KCl;Cl2+2KOH=KCl+KClO+H2O
水溶液中的复分解反应:(Se元素的原子序数为34)
CuSO4+H2S=CuS↓+H2SO4;H2SeO4+2NaN3=Na2SeO4+2HN3;HN3+Na2S=NaN3+H2S
热分解反应:
BaCO3 BaO+CO2↑;MgCO3
BaO+CO2↑;MgCO3 MgO+ CO2↑;CuCO3
MgO+ CO2↑;CuCO3 CuO+ CO2↑
CuO+ CO2↑
下列说法不正确的是
A.氧化性(酸性溶液):PbO2>Fe3+>S
B.还原性(碱性溶液):Fe(OH)2>KCl>Cl2
C.酸性(水溶液):H2S>H2SO4>H2SeO4>HN3
D.热稳定性:CaCO3>FeCO3>Ag2CO3
查看答案和解析>>
科目: 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:选择题
2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中存在Fe3+和Fe2+ B.1.12L气体是NO、NO2的混合气体
C.反应后溶液中c(NO3-)=0.85mol/L D.反应后的溶液最多还能溶解1.4gFe
查看答案和解析>>
科目: 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:实验题
(7分)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。请完成下列填空:
取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 编号 | NaOH溶液的浓度 (mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.50 | 20.00 |
2 | 0.10 | 25.80 | 20.00 |
3 | 0.10 | 22.62 | 20.00 |
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
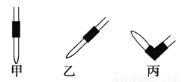
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______(填选项字母)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目: 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:填空题
(共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的原子结构示意图为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素组成的一种正盐,该盐的水溶液呈酸性,用离子方程式解释原因: 。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式 。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:填空题
(15分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知: 《1》CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= 890.3 kJ·mol-1
890.3 kJ·mol-1
《2》CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
《3》2CO(g)+O2(g)=2CO2(g) △H= 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
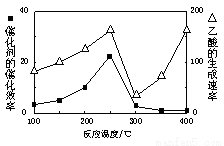
②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)①Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是_____。
A.可在碱性氧化物中寻找
B.可在ⅠA、ⅡA族元素形成的氧化物中寻找
C.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

CO2在电极a放电的反应式是__________________________________________。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:实验题
(14分)某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
III.按如图所示装置连接仪器、检查气密性、装入化学试剂。
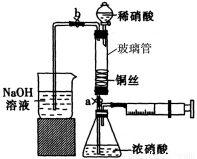
(1)过程I发生反应的离子方程式是 。
(2)写出过程III中检查气密性的方法 。
(3)过程III的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是 ,一段时间后使反应停止的操作是 ,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目是 ,该反应的离子方程式是 。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):
实验编号 | 水温/℃ | 液面上升高度 |
1 | 25 | 超过试管的2/3 |
2 | 50 | 不足试管的2/3 |
3 | 0 | 液面上升超过实验1 |
①根据上表得出的结论是温度越 (填“高”或“低”),进入试管中的溶液越多。
②查阅资料:a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO2 3HNO2 =HNO3+2NO+H2O;
b.HNO2不稳定。
则产生上述现象的原因是 。
查看答案和解析>>
科目: 来源:2014-2015河北省高一12月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.元素的单质一定是由还原该元素的化合物来制得
B.含有最高价元素的化合物不一定具有很强的氧化性
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com