
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
A、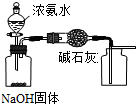 用装置制取干燥纯净的NH3 |
B、 用装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置可证明非金属性Cl>C>Si |
D、 装置向左推动针筒活塞可检验该装置的气密性 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol?L-1 | 0.08 | a | b |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、平衡时,X的转化率为20% |
| B、t℃时,该反应的平衡常数为1600 |
| C、增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
| D、前2min内,用Y变化量表示的平均反应速率v(Y)=0.01mol?L-1?min-1 |
查看答案和解析>>
科目: 来源: 题型:
| A、25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
| B、25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂 |
| C、25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强 |
| D、25℃时,NH4++H2O?NH3?H2O+H+的平衡常数为5.6×10-10 |
查看答案和解析>>
科目: 来源: 题型:
| A、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中,制得碳酸氢钠,再在高温下灼烧,转化为碳酸钠 |
| C、硫酸工业中,在接触室安装热交换器是利用SO3转化为H2SO4时放出的热量 |
| D、电解饱和食盐水制烧碱采用离子交换膜,可防止阳极室产生的H2进入阴极室 |
查看答案和解析>>
科目: 来源: 题型:
 在一定条件下,对于反应mA(g)+n(B)?cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的△H、△S判断正确的是( )
在一定条件下,对于反应mA(g)+n(B)?cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的△H、△S判断正确的是( )| A、△H<0,△S>0 |
| B、△H>0,△S<0 |
| C、△H>0,△S>0 |
| D、△<0,△S<0 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.
以镁橄榄石2MgO?SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖,是一种弱碱性耐火材料.可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬.查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com