
科目: 来源: 题型:
| 50-80℃ |
| 180-200℃ |

查看答案和解析>>
科目: 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.777×10-4 | K=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、0.1mol?L-1NaHCO3溶液中浓度的大小:c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| B、少量的CO2通入到NaCN溶液中:2CN-+H2O+CO2=2HCN+CO32- |
| C、用0.1mol?L-1NaOH溶液中和等浓度等体积的HCN和HCOOH时所需NaOH溶液体积相等 |
| D、相同体积的0.1mol?L-1HCOONa溶液比0.1mol?L-1NaCN溶液所含离子总数相等 |
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取适量反应后的固体放入试管中, |

| SO2被氧化的程度 | V与m1或m2的关系 |
| 未被氧化 | |
| 完全被氧化 | V=0 |
| 部分被氧化 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
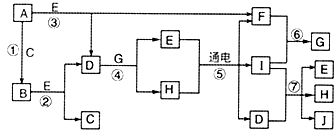 A-J是中学化学常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂.回答下列问题:
A-J是中学化学常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂.回答下列问题:查看答案和解析>>
科目: 来源: 题型:
| A、常温下将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B、未确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;pH<7,H2A是强酸 |
| C、已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
| D、相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水 ②0.1mol/L盐酸 ③0.1mol/L氯化镁溶液 ④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目: 来源: 题型:
| A、酸性由强至弱:HX>HY>H2CO3 |
| B、结合H+的能力:Y->CO32->X->HCO3- |
| C、溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D、NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:
| A、②④ | B、①③ | C、②③ | D、①④ |
查看答案和解析>>
科目: 来源: 题型:
| 序号 | X | Y | Z | W |  |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Fe | FeCl3 | FeCl2 | Fe(OH)2 | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Na | NaOH | Na2CO3 | NaCl |
| A、①③④ | B、①②③ |
| C、②③④ | D、①②④ |
查看答案和解析>>
科目: 来源: 题型:
| A、Ⅰ,① | B、Ⅱ,② |
| C、Ⅲ,③ | D、Ⅳ,④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com