
科目: 来源: 题型:
| A、向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| B、向SO2水溶液中滴加盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸 |
| C、向0.1mol?L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性 |
| D、向2.0mL浓度均为0.1mol?L-1的KCl、KI混合溶液中滴加1~2滴0.01mol?L-1 AgNO3溶液,振荡,沉淀呈黄色,说明同温度下AgCl的Ksp比AgI的Ksp 大 |
查看答案和解析>>
科目: 来源: 题型:
| A、0.2 | B、0.4 |
| C、0.6 | D、0.8 |
查看答案和解析>>
科目: 来源: 题型:
 将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( )
将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( )| A、2.1mL | B、2.4mL |
| C、3.6mL | D、4mL |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、人们在过渡元素中寻找工业催化剂和耐高温、耐腐蚀的合金材料 |
| B、糖类和油脂都能水解 |
| C、重金属盐中毒者可喝大量牛奶解毒 |
| D、煤的燃烧经过脱硫处理,可减少酸雨的形成 |
查看答案和解析>>
科目: 来源: 题型:
 已知CsCl晶体的密度为ρ g/cm3,NA为阿伏加德罗常数,相邻的两个的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )
已知CsCl晶体的密度为ρ g/cm3,NA为阿伏加德罗常数,相邻的两个的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )| A、NA.a3?P | ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目: 来源: 题型:
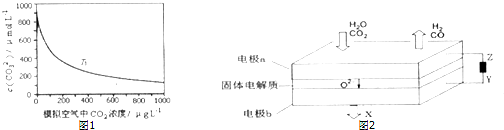
| ||
| 高温 |
查看答案和解析>>
科目: 来源: 题型:

| A、A是反应物 |
| B、前2minA的分解速率为0.1mol?L-1?min-1 |
| C、前2minC的生成速率为0.2mol?L-1?min-1 |
| D、反应的方程式为:2A(g)?2B(g)+C(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com