
科目: 来源: 题型:
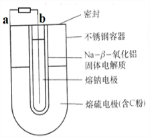
| A、a为电池的正极 |
| B、充电时b接电源的正极 |
| C、正极反应为:nS8+16ne-=8Sn2- |
| D、Na+可以穿过固体电解质和硫反应从而传递电流 |
查看答案和解析>>
科目: 来源: 题型:
A、 NaCl溶液 |
B、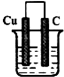 HCl溶液 |
C、 CuSO4溶液 |
D、 蔗糖溶液 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如右图所示,
有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如右图所示,查看答案和解析>>
科目: 来源: 题型:

| A、放电时Li+由B极向A极移动 |
| B、电池放电反应为4Li+O2+2H2O=4LiOH |
| C、正极反应式为O2+4H++4e-=2H2O |
| D、电解液a可以为LiCl溶液 |
查看答案和解析>>
科目: 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目: 来源: 题型:
| A、催化剂可以改变化学反应速率 |
| B、2molSO2与lmolO2混合一定能生成2molSO3 |
| C、食物放在冰箱中会减慢食物变质的速率 |
| D、化学反应达到反应限度时,正反应的速率与逆反应的速率相等 |
查看答案和解析>>
科目: 来源: 题型:
| A、都增大 |
| B、都减小 |
| C、v1增大,v2减小 |
| D、v1减小,v2增大 |
查看答案和解析>>
科目: 来源: 题型:
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,pH均为5的盐酸、氯化铵溶液中,水的电离程度相同 |
| C、8NH3(g)+6NO(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
| D、对于乙酸乙酯的水解反应(△H>0),加入少量氢氧化钠溶液并加热,该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目: 来源: 题型:
| A、上述反应的化学反应速率关系:2 v(NH3)=3 v(H2O) |
| B、若在2L的密闭容器中反应,经过3min后NH3的物质的量由10mol变为7mol 则v (NH3)=0.5mol?L-1?s-1 |
| C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D、若降低温度,反应速率将会减小且平衡将被破坏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com