
科目: 来源: 题型:
| A、H2SO4发生氧化反应 |
| B、NaClO3是还原剂 |
| C、Na2SO4是还原产物 |
| D、当转移1mol电子时,该反应生成1 mol ClO2 |
查看答案和解析>>
科目: 来源: 题型:
| ||
| A、该反应是复分解反应 |
| B、Al2O3 是氧化剂 |
| C、N2发生还原反应 |
| D、每反应1molN2转移3mol电子 |
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| A、反应①中Cl2是还原剂 |
| B、反应①中碳元素被还原 |
| C、反应②中钛元素被氧化 |
| D、反应②中TiCl4是氧化剂 |
查看答案和解析>>
科目: 来源: 题型:
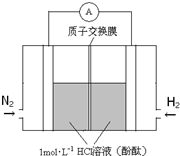 研究氮的固定具有重要意义.
研究氮的固定具有重要意义.| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目: 来源: 题型:
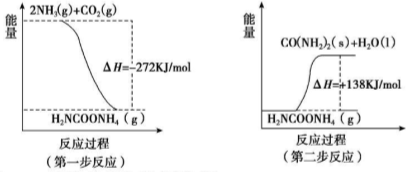
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目: 来源: 题型:
| 对应温度下样品失重的质量 |
| 样品的初始质量 |
| 序号 | 温度范围/℃ | 固体失重率 |
| ① | 120-220 | 19.67% |
| ② | 300-350 | 48.98% |
查看答案和解析>>
科目: 来源: 题型:
 某温度时,在容积为2L的密闭容器中,x、y、z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
某温度时,在容积为2L的密闭容器中,x、y、z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:查看答案和解析>>
科目: 来源: 题型:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A、0.1 mol/L 的CH3COOH的 pH比0.1mol/L HCN的pH大 |
| B、等物质的量浓度溶液pH关系:pH(CH3COONa)<pH(NaHCO3)<pH(NaCN) |
| C、向NaCN溶液中通入少量CO2:CO2+H2O+2NaCN═2HCN+Na2CO3 |
| D、NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com