
科目: 来源: 题型:
| A、元素原子量的递增,量变引起质变 |
| B、元素的原子半径呈周期性变化 |
| C、元素原子的核外电子排布呈周期性变化 |
| D、元素的金属性和非金属性呈周期性变化 |
查看答案和解析>>
科目: 来源: 题型:
| A、同族元素在性质上的相似性,取决于原子价电子排布的相似性 |
| B、电离能越小,表示气态时该原子越易失去电子 |
| C、元素的电负性越大,表示其原子在化合物中吸引电子能力越强 |
| D、电负性大的元素易呈现正价,电负性小的元素易呈现负价 |
查看答案和解析>>
科目: 来源: 题型:
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目: 来源: 题型:
| A、在元素周期表中,每个纵列的价电子层的电子总数一定相等 |
| B、在元素周期表中,s区,d区和ds区的元素都是金属 |
| C、可能存在核外电子排布为1s22s22p63s23p64s24p1的基态原子 |
| D、在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区空间出现概率的大小 |
查看答案和解析>>
科目: 来源: 题型:
 已知反应:2CH3COCH3(l)
已知反应:2CH3COCH3(l) | 催化剂 |
| A、b代表0℃下CH3COCH3的Y-t曲线 | ||
B、反应进行到20min末,H3COCH3的
| ||
| C、升高温度可缩短反应达平衡的时间并能提高平衡转化率 | ||
D、从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
|
查看答案和解析>>
科目: 来源: 题型:
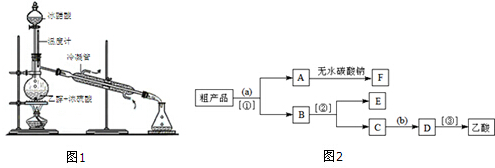
查看答案和解析>>
科目: 来源: 题型:
| A、原气体中一定含有CH4 |
| B、原气体中可能不含CH4 |
| C、原气体中若含有CO,则一定含有H2 |
| D、气体中若同时含有CH4、CO和H2,则CO与H2的物质的量之比为1:2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、8、18、32、32 |
| B、8、18、18、32 |
| C、8、18、18、18 |
| D、8、8、18、18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com