
科目: 来源: 题型:
| A、X的氢化物溶于水生成弱酸 |
| B、Z的氢化物的水溶液在空气中存放不易变质 |
| C、Y与X可生成Y3X2型化合物 |
| D、Z的单质在氧气中燃烧可以生成两种酸性氧化物 |
查看答案和解析>>
科目: 来源: 题型:
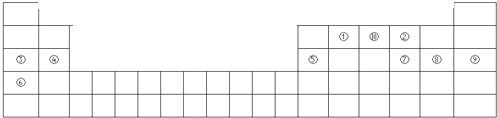
 标出原电池的电极材料和电解质溶液,并写出负极的电极反应为
标出原电池的电极材料和电解质溶液,并写出负极的电极反应为| 原子 | N | S | O | Si |
| 半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
查看答案和解析>>
科目: 来源: 题型:
| c(H2SO3) |
| c(HSO3-) |

查看答案和解析>>
科目: 来源: 题型:
| A、稀释溶液,HA电离平衡常数增大 |
| B、升高温度,HA电离程度增大 |
| C、加入NaA固体,平衡朝正反应方向移动 |
| D、加入NaOH固体,溶液pH减小 |
查看答案和解析>>
科目: 来源: 题型:
| L/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| c2(Z) |
| c(X)?c(Y) |
查看答案和解析>>
科目: 来源: 题型:
| A、1 L CH3OH蒸气与1 L水蒸气反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B、1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ 热量 |
| C、相同条件下1 mol CH3OH(g)与1 mol H2O(g)的能量总和小于1 mol CO2(g)与3 mol H2(g)的能量总和 |
| D、1 mol CH3OH蒸气与1 mol液态水反应生成1 mol CO2气体与3 mol氢气吸收的热量小于49.0 kJ |
查看答案和解析>>
科目: 来源: 题型:
 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.下列判断正确的是( )
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.下列判断正确的是( )| A、相同体积时,c点溶液中和碱的能力大于a点 |
| B、b点溶液的导电性比c点溶液的导电性强 |
| C、b点酸的浓度大于a点酸的浓度 |
| D、Ⅱ为盐酸稀释时的pH变化曲线 |
查看答案和解析>>
科目: 来源: 题型:
| A、①②③④⑤ |
| B、②③④⑥⑦ |
| C、②③⑤⑥⑦ |
| D、①②⑤⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A、在冰醋酸中这四种酸都没有完全电离 |
| B、在冰醋酸中高氯酸是这四种酸中最强的酸 |
| C、在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42- |
| D、酸的强弱与其本身的结构和溶剂的性质有关 |
查看答案和解析>>
科目: 来源: 题型:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com