
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、最终得到白色沉淀和无色溶液 |
| B、最终得到白色沉淀是等物质的量的两种化合物的混合物 |
| C、混合过程中,逸出无色气体 |
| D、在最终得到的溶液中c(Cu2+)=0.01mol/L物 |
查看答案和解析>>
科目: 来源: 题型:
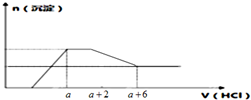 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化的如图所示,下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化的如图所示,下列说法正确的是( )| A、原溶液一定含有Na2SO4 |
| B、反应最后形成的溶液中的溶质为NaCl |
| C、原溶液中一定含有的阴离子是OH-、CO32-、AlO2-、SO42- |
| D、原溶液中含有CO32- 与AlO2-的物质的量之比为3:4 |
查看答案和解析>>
科目: 来源: 题型:
| A、1s22s12p1表示的是激发态原子的电子排布 |
| B、元素的发射光谱一般是亮背景、暗线、线状不连续 |
| C、同一原子中,1s,2s,3s电子的能量逐渐减小 |
| D、各能层的能级都是从s能级开始至f能级结束 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、镁原子:1s22s22p63s2 |
| B、铝离子:1s22s22p6 |
| C、S2-:1s22s22p63s23p4 |
| D、氟原子:1s22s22p5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com