
科目: 来源: 题型:

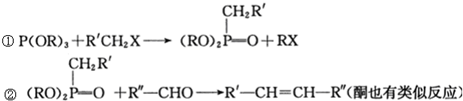
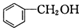 和P(OC2H5)3为原料,选择适当的无机试剂和催化剂,通过合理的途径合成
和P(OC2H5)3为原料,选择适当的无机试剂和催化剂,通过合理的途径合成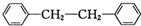 .请补全下列合成路线(含条件、试剂和主要产物的结构简式).
.请补全下列合成路线(含条件、试剂和主要产物的结构简式).
查看答案和解析>>
科目: 来源: 题型:
 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、CH4-8e-+8OH-=CO2+6H2O |
| B、O2+4H++4e-=2H2O |
| C、CH4+10OH--8e-=C32-+7H2O |
| D、O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 放电 |
| 充电 |

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、2.8g | B、4.2g |
| C、11.2g | D、5.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com