
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、C8H18(l)+12.5O2 (g)=8CO2 (g)+9H2O(l)△H=-5518 kJ?mol-1 |
| B、KOH(aq)+CH3COOH (aq)=CH3COOK(aq)+H2O(l)△H=-57.3 kJ?mol-1 |
| C、2H2(g)+O2(g)=2H2O(l)△H=-572kJ?mol-1 |
| D、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-533kJ?mol-1 |
查看答案和解析>>
科目: 来源: 题型:
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶 液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) |
| B、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=KW1X10-9mol?L-1 |
| C、实验②反应后的溶液中:c(A-)+c(HA)>0.1mol?L-1 |
| D、实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目: 来源: 题型:
 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:2- 4 |
| H+ |
| 转化 |
2- 7 |
| Fe2+ |
| 还原 |
| CH- |
| 沉淀 |
查看答案和解析>>
科目: 来源: 题型:
| A、z=4 | ||
| B、B的转化率是40% | ||
| C、A的平衡浓度是1.4 mol?L-1 | ||
D、平衡时气体压强是原来的
|
查看答案和解析>>
科目: 来源: 题型:
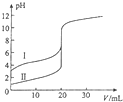 室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A、Ⅱ表示的是滴定醋酸的曲线 |
| B、PH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| C、V(NaOH)=20ml时,C(Cl-)=C(CH3COO-) |
| D、V(NaOH)=10ml时,醋酸溶液中:C(Na+)>C(CH3COO- )>C(H+)>C(OH- ) |
查看答案和解析>>
科目: 来源: 题型:
| A、随着原子序数的递增,原子最外层电子总是从1到8重复出现 |
| B、元素的性质随着元素原子序数的递增而呈周期性变化 |
| C、随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 |
| D、元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化以及元素主要化合价的周期性变化 |
查看答案和解析>>
科目: 来源: 题型:
| X | ||
| Y | Z | R |
| W |
| A、五种元素的原子最外层电子数一定都大于2 |
| B、X、Z原子序数可能相差18 |
| C、Z可能是氯元素 |
| D、Z的氧化物与X单质不可能发生置换反应 |
查看答案和解析>>
科目: 来源: 题型:
| A、第一电离能:B<Be<Mg<Na |
| B、元素的电负性:O>N>S>P |
| C、气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
| D、原子半径:Be<B<C<N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com