
科目: 来源: 题型:
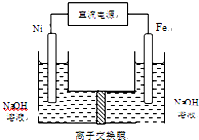 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )| A、铁是阳极,电极反应为Fe-2e-+2OH-═Fe(OH)2 |
| B、电解一段时间后,镍电极附近溶液的pH减小 |
| C、每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
| D、若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- |
查看答案和解析>>
科目: 来源: 题型:

| A、Fe作负极,发生氧化反应 |
| B、盐桥的作用是平衡电荷,构成闭合回路 |
| C、工作一段时间后,NaCl溶液中c(Cl-)不变 |
| D、正极反应:2H++2e-=H2↑ |
查看答案和解析>>
科目: 来源: 题型:
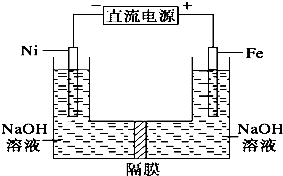
| A、铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+8H+ |
| B、电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C、若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D、电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
查看答案和解析>>
科目: 来源: 题型:
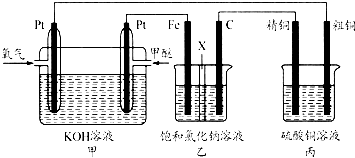
查看答案和解析>>
科目: 来源: 题型:
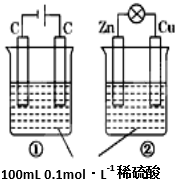
| 选择 | 叙述 | 评价 |
| A | 装置名称:①是电解池,②是原电池 | 错误 |
| B | 硫酸浓度变化:①增大,②减小 | 正确 |
| C | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑ ②中正极:Zn-2e-═Zn2+ | 正确 |
| D | 离子移动方向:①中H+向阴极方向移动 ②中H+向正极方向移动 | 错误 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:
 甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.
甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、回收石墨电极 |
| B、防止电池中渗泄的电解液腐蚀其他物品 |
| C、回收电池外壳的金属材料 |
| D、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com