
科目: 来源: 题型:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
| A、已知t2>t1,HX的生成反应为放热反应 |
| B、在相同条件下,X2平衡转化率:F2>Cl2 |
| C、X2与H2反应的剧烈程度随着原子序数递增逐渐减弱 |
| D、HX的稳定性:HBr>HI |
查看答案和解析>>
科目: 来源: 题型:
 2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )| A、NO2是该过程的中间产物 |
| B、NO和O2必须在催化剂表面才能反应催化剂 |
| C、汽车尾气的主要污染成分是CO2和NO |
| D、该催化转化的总反应方程式为:2NO+O2+4CO═4CO2+N2 |
查看答案和解析>>
科目: 来源: 题型:
| A、NO可以是某些低价N物质氧化的产物 |
| B、NO在人体内可作为信使分子 |
| C、NO是红棕色气体 |
| D、NO可以是某些高价N物质还原的产物 |
查看答案和解析>>
科目: 来源: 题型:
| A、Cu的活动性排在H之后,不能与浓H2SO4发生反应 |
| B、金刚石是自然界中硬度最大的物质,不能氧气发生反应 |
| C、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、它们均为酸性氧化物 |
| B、都溶于水,都能与强碱反应 |
| C、S元素和Si元素化合价都为+4价,因此从氧化还原角度考虑他们具有一样的性质 |
| D、SiO2可与HF反应,这是SiO2作为酸性氧化物的通性 |
查看答案和解析>>
科目: 来源: 题型:
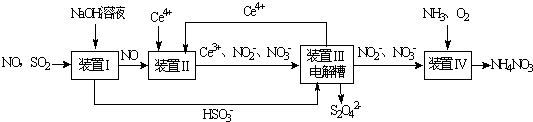
查看答案和解析>>
科目: 来源: 题型:
| A、水果、蔬菜多属于酸性食物 |
| B、煤中加入适量石灰石可减少SO2的排放 |
| C、青霉素是最重要的抗生素,具有消炎的作用 |
| D、误食重金属盐中毒,可通过喝大量牛奶缓解毒性 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com