
科目: 来源: 题型:
| A、某溶液加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有HCO3-或CO32- |
| B、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| C、欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目: 来源: 题型:
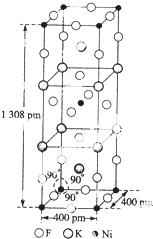 尿素(H2NCONH2 )可用于制有机铁肥.主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]
尿素(H2NCONH2 )可用于制有机铁肥.主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]查看答案和解析>>
科目: 来源: 题型:
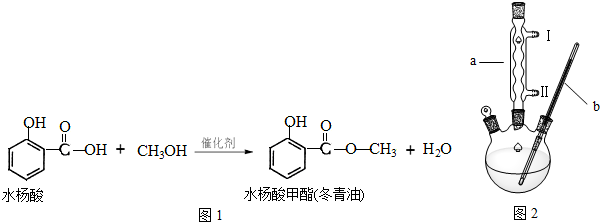
查看答案和解析>>
科目: 来源: 题型:
| A、向溶液中加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不溶解,则原溶液中一定含有SO42- |
| B、向溶液中滴加浓NaOH溶液并加热,产生的气体能使湿润的蓝色石蕊试液变红,则原溶液中一定含有NH4+ |
| C、向溶液中加入几滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制氯水,溶液变为血红色,该溶液中一定含有Fe2+ |
| D、向溶液中滴加稀盐酸产生无色无味气体,产生的气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- |
查看答案和解析>>
科目: 来源: 题型:
| A、向0.10 mol?L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 | ||
| B、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | ||
C、向0.1 mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
| ||
| D、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后,滴入石蕊试液 |
查看答案和解析>>
科目: 来源: 题型:
| A、②④⑥ | B、①③⑤ |
| C、①②④⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:
| A、向浸取液中加入BaCl2有白色沉淀,说明其中含有SO42- |
| B、向浸取液中加入AgNO3溶液有白色沉淀,说明其中含有Cl- |
| C、洁净的铂丝蘸取浸取液少许,在酒精灯火焰上灼烧,火焰呈黄色,不能确定是否含K+ |
| D、向浸取液中滴加稀硫酸,产生无色无味的气体,说明其中含有CO32- |
查看答案和解析>>
科目: 来源: 题型:
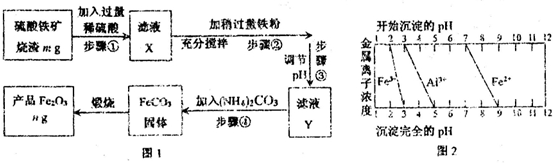
查看答案和解析>>
科目: 来源: 题型:
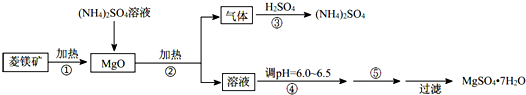
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com