
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
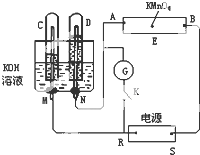 如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示.
如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
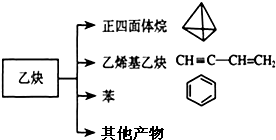 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
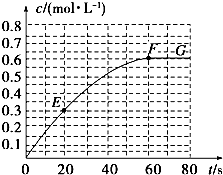 298K时,某容积固定为1L的密闭容器中加入0.5mol A发生如下可逆反应:A(g)═2B(g)△H=a kJ?mol-1.其中B的物质的量浓度随时间变化如图.
298K时,某容积固定为1L的密闭容器中加入0.5mol A发生如下可逆反应:A(g)═2B(g)△H=a kJ?mol-1.其中B的物质的量浓度随时间变化如图.| 1 |
| 6 |
查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com