
科目: 来源: 题型:
| A、①③⑤ | B、②④⑤⑥ |
| C、①③④⑤⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:
| A、Na2SO4 |
| B、CH3COOH |
| C、NaOH |
| D、CH3COOK |
查看答案和解析>>
科目: 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| 5n(NO)(mol) | 0.020 | 0.010 | 0.006 | 0.004 | 0.004 | 0.004 |
查看答案和解析>>
科目: 来源: 题型:
| A、过氧化钠和水反应:2Na2O2+2H2O=4Na++4OH-+O2↑ |
| B、用铜为电极电解饱和食盐水:2Cl-+2H2O=Cl2↑+H2↑+2OH- |
| C、在明矾溶液中滴加过量氨水:Al3++3OH-=Al(OH)3↓ |
| D、向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
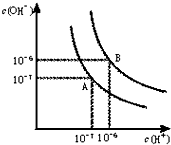 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示. 查看答案和解析>>
科目: 来源: 题型:
| A、达到化学平衡时,4υ正(O2)=5υ逆(NO) |
| B、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C、达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少 |
| D、化学反应速率关系是:2υ正(NH3)=3υ正(H2O) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com