
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

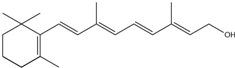
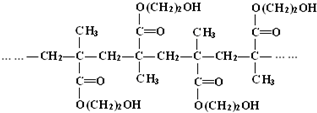
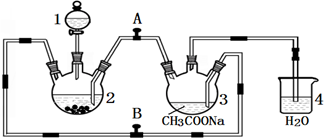
查看答案和解析>>
科目: 来源: 题型:
| A、2:2:3 |
| B、1:1:3 |
| C、1:1:1 |
| D、3:3:1 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 21.98 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 22.02 | 20.00 |
查看答案和解析>>
科目: 来源: 题型:
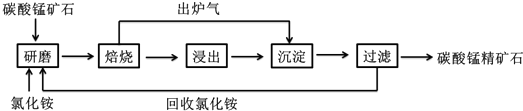
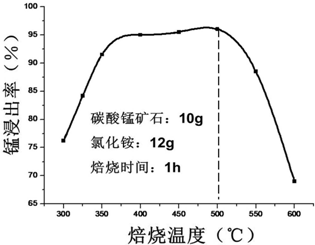
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
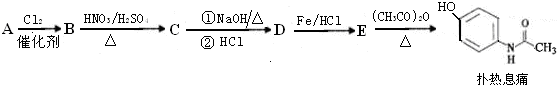

查看答案和解析>>
科目: 来源: 题型:
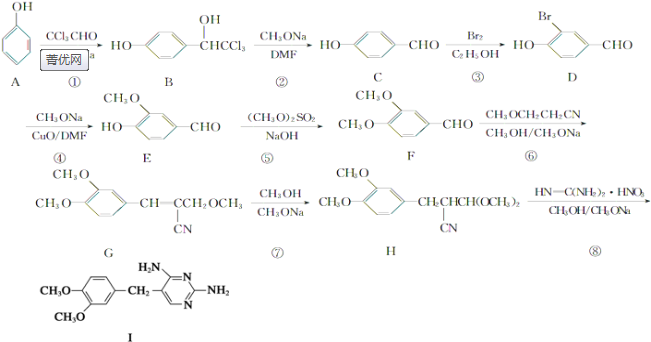
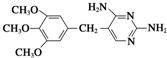 的副产物,为了使该产物的含量降到最低,需要合成路线中第
的副产物,为了使该产物的含量降到最低,需要合成路线中第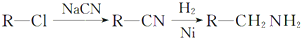 .化合物
.化合物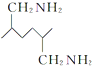 是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH| 浓硫酸 |
| 170℃ |
| 高温高压 |
| 催化剂 |
查看答案和解析>>
科目: 来源: 题型:
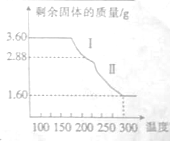 铁及铁的化合物用途非常广泛.
铁及铁的化合物用途非常广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com