
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
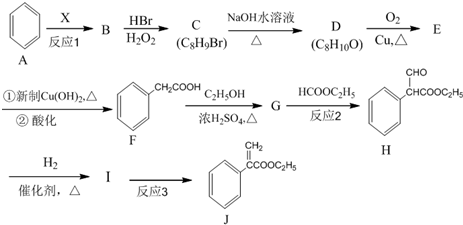
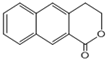 是一种重要的药物合成中间体,请结合题目所给信息,写出以
是一种重要的药物合成中间体,请结合题目所给信息,写出以 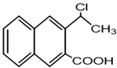 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目: 来源: 题型:
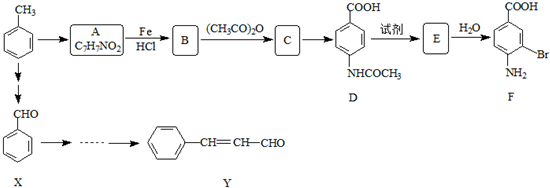
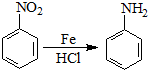

| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
| 合成路线: |
查看答案和解析>>
科目: 来源: 题型:
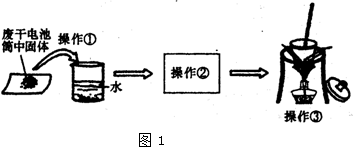 日常生活中使用的锌锰干电池,电池外壳是锌片,中心是石墨棒,在外壳和石墨之间填充二氧化锰和碳粉以及氯化锌及氯化铵的糊状物.某研究性学习小组对干电池的填充物质进行了如图1实验.
日常生活中使用的锌锰干电池,电池外壳是锌片,中心是石墨棒,在外壳和石墨之间填充二氧化锰和碳粉以及氯化锌及氯化铵的糊状物.某研究性学习小组对干电池的填充物质进行了如图1实验.
查看答案和解析>>
科目: 来源: 题型:
| 物质 | CH4 | CH3OH(l) | CH3CH2OH(l) | CO(g) | H2(g) |
| 燃烧热△H/kJ?mol-1 | -890.31 | -726.51 | -1366.8 | -283 | -285.8 |
| A、-247.3kJ?mol-1 |
| B、+247.3kJ?mol-1 |
| C、+321.5kJ?mol-1 |
| D、-321.5kJ?mol-1 |
查看答案和解析>>
科目: 来源: 题型:
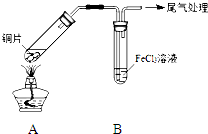 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.| 步骤① | 配制1mol?L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
| 步骤② | 往5mL 1mol?L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol?L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目: 来源: 题型:

| x |
| 2 |
| x |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |

查看答案和解析>>
科目: 来源: 题型:
| 1173K |
| 1220K~1420K |
| A、反应Ⅰ中的TiO2是氧化剂 |
| B、TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂 |
| C、a=b=c=2 |
| D、每生成9.6 g Ti,反应Ⅰ、Ⅱ中共转移0.8 mol电子 |
查看答案和解析>>
科目: 来源: 题型:
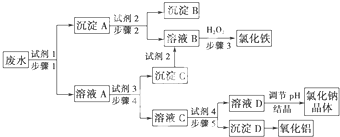
查看答案和解析>>
科目: 来源: 题型:
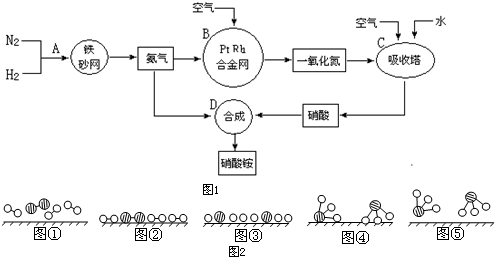
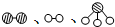 分别表示N2、H2、NH3.
分别表示N2、H2、NH3.
| ||
| △ |
| 注意事项 | 理由 | |
| ① | ||
| ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com