
科目: 来源: 题型:
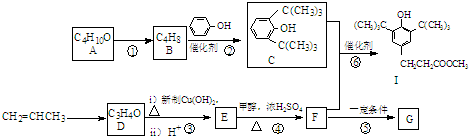

查看答案和解析>>
科目: 来源: 题型:
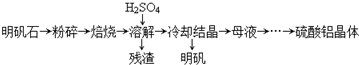
| 物质 | α-Al2O3 | γ-Al2O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
| 温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
查看答案和解析>>
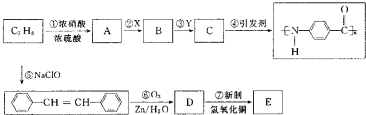
科目: 来源: 题型:
 CH2COOC2H5+CH3CH2OH
CH2COOC2H5+CH3CH2OH )合成化合物Ⅴ的线路如下:
)合成化合物Ⅴ的线路如下:
查看答案和解析>>
科目: 来源: 题型:
| O2,Zn/H2O |
查看答案和解析>>
科目: 来源: 题型:
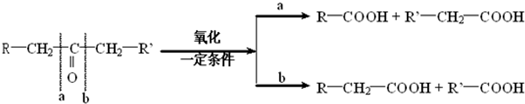
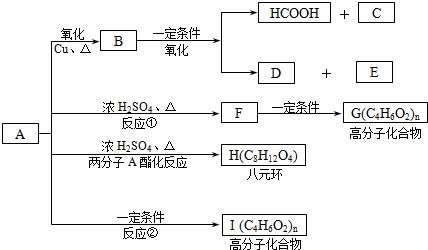
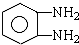 )缩聚生成一种合成纤维:
)缩聚生成一种合成纤维:查看答案和解析>>
科目: 来源: 题型:
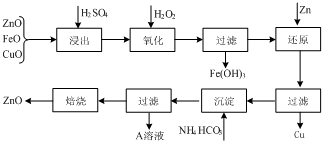
查看答案和解析>>
科目: 来源: 题型:
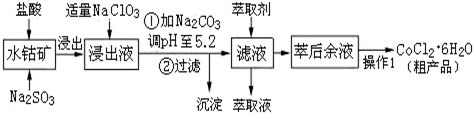
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:
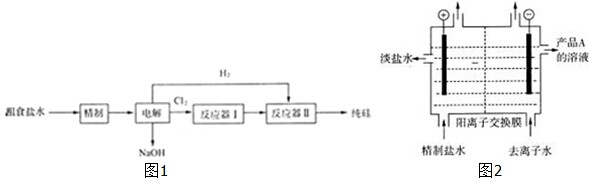
查看答案和解析>>
科目: 来源: 题型:
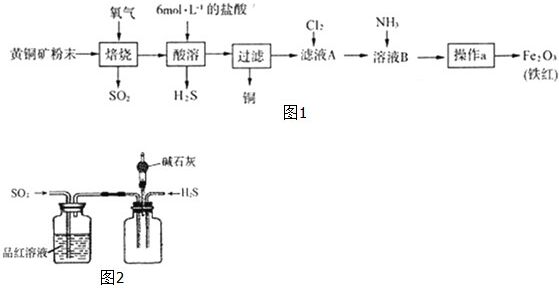
| ||
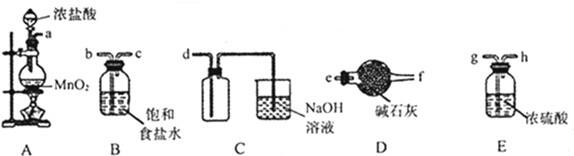
查看答案和解析>>
科目: 来源: 题型:
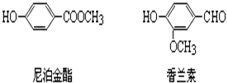 分子式为C8H8O3的芳香族化合物有多种结构,这些物质在食品、化妆品行业有广泛用途.
分子式为C8H8O3的芳香族化合物有多种结构,这些物质在食品、化妆品行业有广泛用途.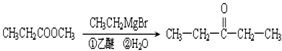
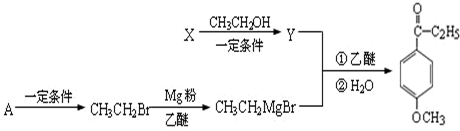
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com