
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、25℃时,纯重水pD=7 |
| B、25℃时,0.1mol/L NaCl的重水溶液pD=pOD=6 |
| C、25℃时,1mol/L的DCl的重水溶液pD=0,pOD=14 |
| D、25℃时,0.01mol/L NaOD的重水溶液中pD=12 |
查看答案和解析>>
科目: 来源: 题型:
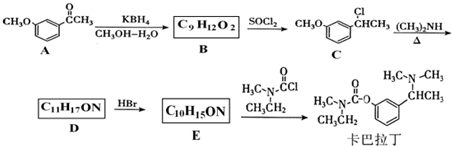
 基团 ②属于α-氨基酸 ③含有三个手性碳原子.
基团 ②属于α-氨基酸 ③含有三个手性碳原子. )和丙酮(
)和丙酮(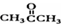 ) 制备化合物
) 制备化合物  的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH| 浓硫酸 |
| 170℃ |
| Br2 |
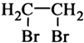
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
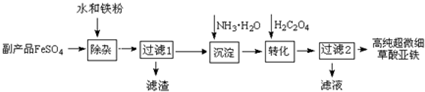
查看答案和解析>>
科目: 来源: 题型:
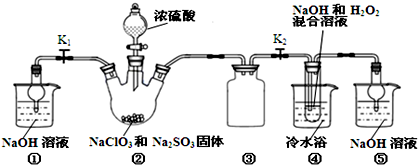
查看答案和解析>>
科目: 来源: 题型:
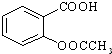 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水 S杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水 S杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: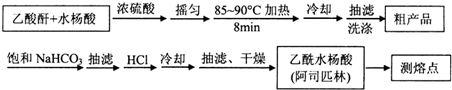
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
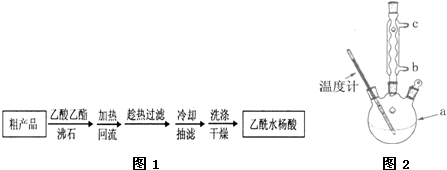
查看答案和解析>>
科目: 来源: 题型:
| A、X的氢化物溶于水显酸性 |
| B、X与Y形成化合物的化学式为X2Y3 |
| C、Y的氧化物是离子化合物 |
| D、X和Z的最高价氧化物对应的水化物都是弱酸 |
查看答案和解析>>
科目: 来源: 题型:
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A、离子半径大小:R3+<X+<M2- |
| B、Y与M组成的化合物是光化学烟雾的原因之一 |
| C、将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 |
| D、M氢化物的熔沸点高于Z氢化物的熔沸点 |
查看答案和解析>>
科目: 来源: 题型:
| A、上述实验中,共有两个氧化还原反应 |
| B、上述实验证明还原性:Fe2+>Br->Cl->Mn2+ |
| C、实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D、实验③证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com